题目内容
12.化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如图所示.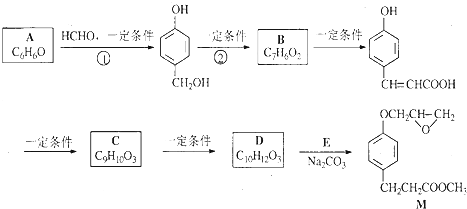
已知:RONa+R′X→ROR′+NaX
根据题意完成下列填空:
(1)写出反应类型:反应①加成反应 反应②氧化反应
(2)写出结构简式:A
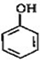 B
B C
C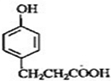
(3)写出
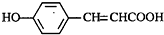 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.(4)由C生成D的另一个反应物是CH3OH,反应条件是浓硫酸、加热.
(5)E的结构简式为
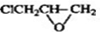 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式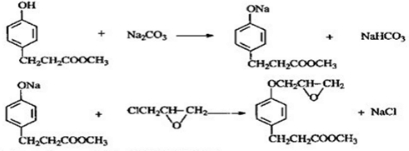 .
.
分析 由反应①的生成物可知,A为 ,与HCHO发生加成反应生成
,与HCHO发生加成反应生成 ,反应②为醇的氧化反应,B为
,反应②为醇的氧化反应,B为 ,由碳链的骨架可知,C为
,由碳链的骨架可知,C为 ,D为
,D为 ,由M的结构可知,E为
,由M的结构可知,E为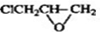 ,然后结合有机物的结构和性质来解答.
,然后结合有机物的结构和性质来解答.
解答 解:由反应①的生成物可知,A为 ,与HCHO发生加成反应生成
,与HCHO发生加成反应生成 ,反应②为醇的氧化反应,B为
,反应②为醇的氧化反应,B为 ,由碳链的骨架可知,C为
,由碳链的骨架可知,C为 ,D为
,D为 ,由M的结构可知,E为
,由M的结构可知,E为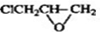 ,
,
(1)由上述分析可知,①为加成反应,②为氧化反应,故答案为:加成反应;氧化反应;
(2)由上述分析可知,A为 ,B为
,B为 ,C为
,C为 ,故答案为:
,故答案为: ;
; ;
; ;
;
(3) 的邻位异构体分子内脱水产物香豆素的结构简式为
的邻位异构体分子内脱水产物香豆素的结构简式为 ,反应方程式为
,反应方程式为 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,故答案为:
+H2O,故答案为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(4)C、D相差1个C原子,则另一反应物为CH3OH,反应条件为浓硫酸、加热,发生酯化反应,故答案为:CH3OH;浓硫酸、加热;
(5)通过以上分析知,E结构简式为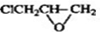 ,由D生成M的化学反应方程式为
,由D生成M的化学反应方程式为 ,
,
故答案为: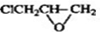 ;
; .
.
点评 本题考查有机物的合成,侧重考查学生分析推断能力,注意碳链骨架、官能团的变化、反应条件与反应类型的关系即可解答,注意反应前后各物质断键和成键方式,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | Fe3O4与HCl:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | Fe2O3与Hl:Fe2O3+6H+═2Fe3++3H2O |
20.在每次焰色反应实验前,都要用某试剂清洗铂丝,这种试剂是( )
| A. | 盐酸 | B. | 硫酸 | C. | 烧碱溶液 | D. | 纯碱溶液 |
7.下列有关物质应用的说法正确的是( )
| A. | 生石灰用作食品抗氧剂 | B. | 小苏打是面包发酵粉的主要成分 | ||
| C. | 铝罐可久盛食醋 | D. | 盐类都可作调味品 |
17.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O)的流程如下:

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的bd(填代号).
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)检验溶液Ⅰ中的存在Fe3+实验操作是取少量溶液I于试管中,滴加KSCN溶液,若溶液变红色,证明溶液里有Fe3+.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因H2S+Cu2+=CuS↓+2H+;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉;
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为$\frac{cV×1{0}^{-3}mol×10×171g/mol}{mg}$×100%(用含m,c,V的代数式表示,不用化简).
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的bd(填代号).
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)检验溶液Ⅰ中的存在Fe3+实验操作是取少量溶液I于试管中,滴加KSCN溶液,若溶液变红色,证明溶液里有Fe3+.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因H2S+Cu2+=CuS↓+2H+;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉;
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为$\frac{cV×1{0}^{-3}mol×10×171g/mol}{mg}$×100%(用含m,c,V的代数式表示,不用化简).
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
1.以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
| A. | 粗铜与直流电源负极相连 | |
| B. | 相同时间内阳极质量变化与阴极质量变化可能不同 | |
| C. | 硫酸铜溶液浓度始终保持不变 | |
| D. | 杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥” |
2.下列对化学反应的认识,不正确的是( )
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
 如图甲、乙是电化学实验装置.请回答下列问题:
如图甲、乙是电化学实验装置.请回答下列问题: