题目内容
3.实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理为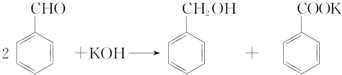
部分试剂的物理常数如下表所示:
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
在锥形瓶中,加13.5g KOH、13.5mL H2O,在不断振荡下分批加入新制的苯甲醛,共加入15mL新制的苯甲醛,塞紧瓶口,用力振摇得到白色糊状物,放置24h以上.
向锥形瓶中加入大约45mL水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45mL乙醚分三次萃取苯甲醇,合并乙醚萃取液.保存水溶液留用.
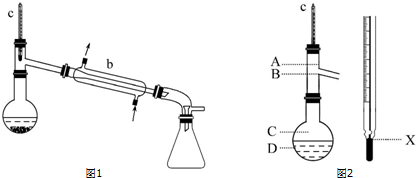
依次用15mL 25%的亚硫酸氢钠溶液及8mL水洗涤乙醚萃取液,再加入少量无水硫酸镁静置片刻,过滤除去MgSO4固体.把乙醚萃取液倒入圆底烧瓶,加入2小片碎瓷片,先水浴蒸馏,再用酒精灯加热蒸馏,收集产品可得苯甲醇(装置如图1所示).
制取纯净苯甲酸的过程略.
试完成下列问题:
(1)仪器b的名称为冷凝管.
(2)混合苯甲醛、氢氧化钾和水应选用的锥形瓶要用胶塞塞住,其原因是防止苯甲醛被空气中的氧气氧化.
(3)若将苯甲醛一次性倒入锥形瓶,可能导致A、D.
A.反应太剧烈B.液体太多无法振荡C.反应变缓慢D.产率降低
(4)分液漏斗使用前须检查是否漏水(或检漏)并洗净备用.
(5)制取苯甲醇时,用25%亚硫酸氢钠溶液洗涤是为了除去未反应的苯甲醛.实验中加入少量无水MgSO4的目的是干燥乙醚萃取液.
(6)在使用图2所示仪器的操作中,温度计水银球的上沿X的放置位置为B(填图示“A”“B”“C”或“D”).
(7)蒸馏过程中水浴加热蒸出的主要为乙醚,然后加热收集沸点204~206℃的馏分得到苯甲醇.某同学一次实验中发现温度在178~180℃时有少量液体蒸出,则该馏分可能为苯甲醛.
分析 苯甲醛与KOH反应生成白色糊状物为苯甲醇、苯甲酸钾的混合物,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,蒸馏、萃取得到产品甲为苯甲醇;依据蒸馏、萃取及物质的相关性质来解答.
(1)蒸馏装置中的仪器名称;
(2)苯甲醛容易被空气中的氧气氧化;
(3)若将苯甲醛一次性倒入锥形瓶,则反应太剧烈,混合液温度升高,导致苯甲醛、苯甲醇挥发,同时副产物增多,产率降低;
(4)分液漏斗使用前首先应检查是否漏液;
(5)无水硫酸镁起到干燥作用;
(6)蒸馏过程中,温度计的水银球上沿应与蒸馏支管下沿相平;
(7)蒸馏的混合液主要是乙醚和苯甲醇,根据它们的沸点,首先水浴蒸馏蒸出的是乙醚.根据沸点在178~180℃,该馏分应为苯甲醛.
解答 解:(1)蒸馏装置中的冷凝管,故答案为:冷凝管;
(2)苯甲醛容易被空气中的氧气氧化,因此锥形瓶要用胶塞塞住,故答案为:防止苯甲醛被空气中的氧气氧化;
(3)若将苯甲醛一次性倒入锥形瓶,则反应太剧烈,混合液温度升高,导致苯甲醛、苯甲醇挥发,同时副产物增多,产率降低,故答案为:A、D;
(4)分液漏斗使用前首先应检查是否漏液,故答案为:检查是否漏水(或检漏);
(5)无水硫酸镁起到干燥作用,故答案为:干燥乙醚萃取液;
(6)蒸馏过程中,温度计的水银球上沿应与蒸馏支管下沿相平,故答案为:B;
(7)蒸馏的混合液主要是乙醚和苯甲醇,根据它们的沸点,首先水浴蒸馏蒸出的是乙醚.根据沸点在178~180℃,该馏分应为苯甲醛,故答案为:乙醚,苯甲醛.
点评 本题考查制备方案的设计,为高频考点,题目难度中等,把握有机物的性质及分离流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在.图(a)为目前国际上磷矿石利用的大致情况.其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸.图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程.

部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=5CaSO4+HF↑+3H3PO4.现有1t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=5CaSO4+HF↑+3H3PO4.现有1t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
19.短周期元素X、Y、Z、M 的原子序数依次增大,元素X 的一种单质是高硬度的宝石,Y2+的电子层结构与氖相同,Z的质子数为偶数.室温下M 的单质为淡黄色固体.下列说法正确的是( )
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
6.Fe2+既具有氧化性,又具有还原性,下列有关分析中正确的是( )
| 编号 | 半反应式 | Fe2+表现的性质 | 完成该半反应式选用的物质 |
| A | Fe2++2e-═Fe | 氧化性 | I- |
| B | Fe2++2e-═Fe | 还原性 | Al |
| C | Fe2+-e-═Fe3+ | 氧化性 | Fe |
| D | Fe2+-e-═Fe3+ | 还原性 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
8.常温下,0.2mol/L的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )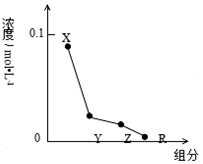

| A. | MOH的电离方程式:MOH═M++OH- | |
| B. | 该混合液中水电离出的c(H+)<l0-7mol/L | |
| C. | 该混合溶液中:c(Y)+c(X)═c(R)+c(Z) | |
| D. | 图中c(X)+c(Z)═0.1mol/L |
12.100mL0.6mol•L-1盐酸加到等体积0.4mol•L-1NaOH溶液中,所得溶液中的 pH值是( )
| A. | 0.2 | B. | 0.7 | C. | 1.0 | D. | 2.0 |
13.下列各选项中所述的两个量,前者一定大于后者的是( )
| A. | 0.10mol•L-1的醋酸溶液和0.01mo•L-1的醋酸溶液中水的电离度 | |
| B. | 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 | |
| C. | 物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度 | |
| D. | 物质的量浓度相等的CH3COONa溶液和 Na2CO3溶液的pH |
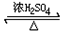 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.