题目内容
3.如图药品和装置合理且能完成相应实验的是( )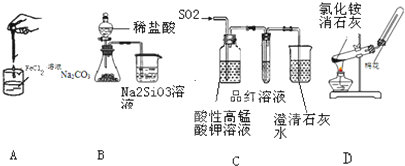
| A. | 制备氢氧化亚铁 | B. | 验证非金属性Cl>C>Si | ||
| C. | 检验二氧化硫中是否混有二氧化碳 | D. | 实验室制取并收集氨气 |
分析 A.制备氢氧化亚铁,应防止氢氧化亚铁被氧化;
B.从酸性的角度比较非金属性,应用最高价氧化物对应的水化物;
C.应先除去二氧化硫,避免干扰;
D.加热固体,应防止试管炸裂.
解答 解:A.氢氧化亚铁不稳定,易被氧气氧化而变质,制备氢氧化亚铁,应将胶头滴管插入液面以下,故A错误;
B.比较非金属性强弱,应用高氯酸,不能用盐酸,故B错误;
C.二氧化硫也与澄清石灰水反应,应先除去二氧化硫,避免干扰,故C正确;
D.加热固体,试管口应略朝下倾斜,以防止试管炸裂,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的制备、检验等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
5.如图实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  蒸馏 | ||
| C. |  过滤 | D. |  稀释浓硫酸 |
6.以下反应不符合绿色化学原子经济性要求的是( )
| A. | CH≡CH+HCl→CH2=CHCl | B. |  | ||
| C. | CH2=CH2+HCl→CH3CH2Cl | D. |  |
8.表为元素周期表的一部分:
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图 .
.
(2)②、③、⑤的离子半径由大到小的顺序为S2->O2->Na+.
(3)元素④和⑥形成的化合物的电子式: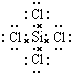 .
.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)画出元素②的离子结构示意图
 .
.(2)②、③、⑤的离子半径由大到小的顺序为S2->O2->Na+.
(3)元素④和⑥形成的化合物的电子式:
 .
.
15.对于反应2SO2(g)+O2(g)?2SO3(g),下列措施能增大反应速率的是( )
①恒容条件下,再通入一定量的O2
②增大体系容积
③恒容条件下,再通入一定量的N2
④使用合适的催化剂.
①恒容条件下,再通入一定量的O2
②增大体系容积
③恒容条件下,再通入一定量的N2
④使用合适的催化剂.
| A. | ①④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
12.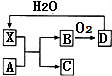 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | X使蔗糖变黑的现象主要体现了X的强氧化性 | |
| B. | 若A为铁,则A与X在室温下不会反应 | |
| C. | 若A为碳单质,则将C通入少量的澄清石灰水中,溶液仍然澄清 | |
| D. | 工业上在高温、常压和使用催化剂的条件下,可以使B完全转化为D |