题目内容
10.按照要求填空(1)N2的电子式:

(2)NH4Cl的电子式:

(3)HClO的结构式:

(4)CO2的结构式:O=C=O
(5)Br2的形成过程:

(6)MgCl2的形成过程:
 .
.
分析 (1)氮气分子中存在氮氮三键,氮原子最外层为8电子,据此书写即可;
(2))氯化铵为离子化合物,阴阳离子都需要标出最外层电子及所带电荷;
(3)次氯酸分子的中心原子为氧原子,O原子分别与H原子和Cl原子形成共价键;
(4)CO2的结构中C原子分别与两个O原子形成双键;
(5)溴单质是溴原子间形成一对共用电子对;
(6)氯化镁是离子化合物,两个氯原子得到电子,一个镁原子失去电子,据此书写电子式形成过程.
解答 解:(1)氮气分子中存在氮氮三键,氮原子最外层为8电子,故N2的电子式为: ,
,
故答案为: ;
;
(2)氯化铵为离子化合物,阴阳离子都需要标出最外层电子及所带电荷,氯化铵正确的电子式为: ,
,
故答案为: ;
;
(3)次氯酸分子中含有1个氧氢键和氧氯键,中心原子为氧原子,其电子式为 ,
,
故答案为: ;
;
(4)CO2的结构中C原子分别与两个O原子形成双键,故其结构式为O=C=O,
故答案为:O=C=O;
(5)溴单质是溴原子间形成一对共用电子对,电子式形成过程为: ,
,
故答案为: ;
;
(6)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查化学用语,学生应注意原子的最外层电子数来分析形成的化合物,离子化合物中有离子,共价化合物中一定没有离子,电子式书写方法是解题关键,题目难度不大.

练习册系列答案
相关题目
20.下列有机物中,不属于羧酸的是( )
| A. | HCOOH | B. | CH3CH2COOH | C. | CH3COOCH3 | D. | HOOC-COOH |
17.下列关于有机物的说法不正确的是( )
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应、中和反应及氧化反应 | |
| D. | 食用植物油在烧碱溶液水解属于皂化反应 |
5.下列说法正确的是( )
| A. | 25℃时,pH=2的硫酸与pH=12的Na0H溶液等体积混合溶液显酸性 | |
| B. | 20mL0.1mol/L二元弱酸H2A溶液与等体积,等浓度的NaOH溶液混合后,混合溶液中c(Na+)=c(H2A)+c(HA-)+c(A2-)=0.1mol/L | |
| C. | 向Na2CO3溶被中通入CO2至溶液为中性,则$\frac{{c(N{a^+})}}{{c(C{O_3}^{2-})}}$>1 | |
| D. | 常温下,向含0.lmolCH3COOH的溶液中加入amolNaOH 固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸的电离常数Ka=1.75×10-5) |
15.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: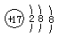 | |
| B. | CH4的球棍模型:? | |
| C. | 氯化镁的电子式: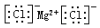 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42ˉ |
2.下列物质中,可用于制作太阳能电池的是( )
| A. | Si | B. | SiO2 | C. | H2SiO3 | D. | Na2SiO3 |
19.下列说法正确的是( )
| A. |  的名称应为2-甲基-2-丙醇 的名称应为2-甲基-2-丙醇 | |
| B. | 2-甲基-3,6-己二醇根据羟基数目分类应属于二元醇 | |
| C. |  的名称为4-甲基-3,4-己二醇 的名称为4-甲基-3,4-己二醇 | |
| D. | 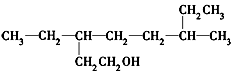 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 |


 .
.