题目内容
铁铝矾[Al2Fe(SO4)4?XH2O]有净水作用,将其溶于水中得到浅绿色溶液,有关溶液的叙述正确的是( )
| A、该溶液呈中性 |
| B、该溶液中:2c(Al3+)+c(Fe2+)+c(H+)=4c(SO42-)+c(OH-) |
| C、在空气中蒸干并灼烧该溶液,最后所得残留固体为氧化铝和氧化铁 |
| D、向该溶液中加入氢氧化钡溶液,当SO42-完全沉淀是,Al3+、Fe2+恰好被完全沉淀 |
考点:镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:A、该溶液呈酸性,是因为亚铁离子和铝离子水解呈酸性;
B、由电荷守恒得:3c(Al3+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-);
C、硫酸是不挥发的酸,所以在空气中,蒸干并灼烧该溶液,最后所得的残留固体是硫酸铝和硫酸铁;
D、设铁铝矾[Al2Fe(SO4)4?xH2O]为1mol,当SO42-完全沉淀需4mol的Ba(OH)2溶液电离出8mol的OH-离子与2mol的铝离子和1mol的亚铁离子恰好完全沉淀.
B、由电荷守恒得:3c(Al3+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-);
C、硫酸是不挥发的酸,所以在空气中,蒸干并灼烧该溶液,最后所得的残留固体是硫酸铝和硫酸铁;
D、设铁铝矾[Al2Fe(SO4)4?xH2O]为1mol,当SO42-完全沉淀需4mol的Ba(OH)2溶液电离出8mol的OH-离子与2mol的铝离子和1mol的亚铁离子恰好完全沉淀.
解答:
解:A、亚铁离子和铝离子水解呈酸性,故A错误;
B、由电荷守恒得:3c(Al3+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-),故B错误;
C、硫酸是不挥发的酸,所以在空气中,蒸干并灼烧该溶液,最后所得的残留固体是硫酸铝和硫酸铁,故C错误;
D、设铁铝矾[Al2Fe(SO4)4?xH2O]为1mol,当SO42-完全沉淀需4mol的Ba(OH)2溶液电离出8mol的OH-离子与2mol的铝离子和1mol的亚铁离子恰好完全沉淀,故D正确;
故选D.
B、由电荷守恒得:3c(Al3+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-),故B错误;
C、硫酸是不挥发的酸,所以在空气中,蒸干并灼烧该溶液,最后所得的残留固体是硫酸铝和硫酸铁,故C错误;
D、设铁铝矾[Al2Fe(SO4)4?xH2O]为1mol,当SO42-完全沉淀需4mol的Ba(OH)2溶液电离出8mol的OH-离子与2mol的铝离子和1mol的亚铁离子恰好完全沉淀,故D正确;
故选D.
点评:本题考查元素化合物知识与相关反应原理相结合考查,注意电荷守恒的应用,水解原理的考查.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,14 g CO中含有的原子数目为NA |
| B、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
| C、25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-数目为0.2 NA |
| D、1L1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
下列各组反应中最终肯定不生成白色沉淀的是( )
| A、AlCl3溶液中加入过量的氨水 |
| B、MgCl2溶液中加入过量的氨水 |
| C、Al2(SO4)3溶液中加入过量的KOH溶液 |
| D、MgSO4溶液中加入过量的KOH溶液 |
下列各组离子能大量共存的是( )
| A、I-、ClO-、H+、Na+ |
| B、K+、HCO3-、OH-、NH4+ |
| C、Fe3+、Cu2+、SO42-、Cl- |
| D、Ca2+、Na+、SO42-、SO32- |
元素周期表和元素周期律的有关说法,正确的是( )
| A、元素周期表第8、9、10三纵列合称Ⅷ族,Ⅷ族是元素周期表所有族中元素种类最多的族 |
| B、元素周期表中的所有副族元素都是金属元素,副族包含过渡元素和Ⅷ族 |
| C、在同一主族中,从上到下,F、Cl、Br、I的非金属性逐渐减弱 |
| D、因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S |
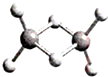 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法错误的是( )| A、氢铝化合物与水反应生成氢氧化铝和氢气 |
| B、Al2H6中含有离子键和极性共价键 |
| C、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| D、氢铝化合物中可能存在组成为AlnH2n+2的物质(n为正整数) |
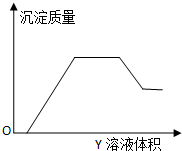 向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )