题目内容
2.综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示:
(1)反应①~⑤中,属于氧化还原反应的是⑤(填编号).
(2)写出反应②的离子方程式Mg(OH)2+2H+=Mg2++H2O.
(3)X溶液中的主要阳离子是Na+和NH4+.
(4)检验纯碱样品中是否含NaCl应选用的试剂是稀硝酸、AgNO3溶液.
分析 将海水蒸发浓缩、冷却结晶得到粗盐和母液,向母液中加入Ca(OH)2,发生反应Mg2++2OH-=Mg(OH)2↓,过滤得到Mg(OH)2沉淀,将Mg(OH)2溶于稀盐酸中发生反应Mg(OH)2+2HCl=MgCl2+2H2O,将溶液蒸发浓缩、冷却结晶得到MgCl2.6H2O,将MgCl2.6H2O晶体在HCl氛围中加热得到固体MgCl2,电解熔融氯化镁得到Mg,发生反应为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
将粗盐提纯得到NaCl溶液,向溶液中通入氨气和二氧化碳,发生反应NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,碳酸氢钠溶解度小于NaCl而析出,所以得到溶液X为NH4Cl溶液,将NaHCO3加热发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,最后得到碳酸钠固体,以此解答该题.
解答 解:将海水蒸发浓缩、冷却结晶得到粗盐和母液,向母液中加入Ca(OH)2,发生反应Mg2++2OH-=Mg(OH)2↓,过滤得到Mg(OH)2沉淀,将Mg(OH)2溶于稀盐酸中发生反应Mg(OH)2+2HCl=MgCl2+2H2O,将溶液蒸发浓缩、冷却结晶得到MgCl2.6H2O,将MgCl2.6H2O晶体在HCl氛围中加热得到固体MgCl2,电解熔融氯化镁得到Mg,发生反应为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
将粗盐提纯得到NaCl溶液,向溶液中通入氨气和二氧化碳,发生反应NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,碳酸氢钠溶解度小于NaCl而析出,所以得到溶液X为NH4Cl溶液,将NaHCO3加热发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,最后得到碳酸钠固体,
(1)①石灰乳与氯化镁反应生成氢氧化镁沉淀和氯化钙,元素化合价不变,非氧化还原反应;
②氢氧化镁沉淀与盐酸反应生成氯化镁和水,元素化合价不变,非氧化还原反应;
③氯化镁溶液蒸发浓缩得到氯化镁晶体,元素化合价不变,非氧化还原反应;
④氯化镁晶体分解得到氯化镁和水,元素化合价不变,非氧化还原反应;
⑤电解氯化镁得到镁和氯气,元素化合价发生变化,氧化还原反应;
故选⑤;
(2)氢氧化镁沉淀与盐酸反应生成氯化镁和水,方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为:Mg(OH)2+2H+=Mg2++H2O;
故答案为:Mg(OH)2+2H+=Mg2++H2O;
(3)向氯化钠溶液中依次通入氨气、二氧化碳,发生反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,所以溶液中含有NH4Cl和NaHCO3,则溶液中的主要阳离子是Na+和NH4+;
故答案为:NH4+;
(4)氯离子能和硝酸酸化的硝酸银溶液反应生成氯化银白色沉淀,所以检验纯碱样品中是否含NaCl应选用的试剂是稀硝酸、AgNO3溶液;
故答案为:稀硝酸、AgNO3溶液.
点评 本题考查物质的分离、提纯以及制备,为高考常见题型,题目侧重考查从海水中得到的粗盐进行提纯,进一步用于氯碱工业以及镁的冶炼,涉及金属制备、元素化合物性质、常用化学用语等,难度不大.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 干电池中Zn为负极,炭为正极 | |
| B. | 干电池工作时,电子由Zn极经外电路流向炭极 | |
| C. | 干电池长时间连续使用时内装糊状物可能流出腐蚀电器 | |
| D. | 干电池可以实现化学能向电能的转化和电能向化学能的转化 |
| A. | 分子中所有原子都有可能处于同一平面上 | |
| B. | 都能在空气中燃烧,且燃烧时均伴有黑烟 | |
| C. | 都能被KMnO4酸性溶液氧化而使其褪色 | |
| D. | 都能与足量的溴水发生加成反应生成相同的四溴代烷 |
 .已知有机物X的键线式为
.已知有机物X的键线式为 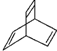 ,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )
,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )| A. | Y的结构简式为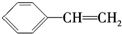 | |
| B. | Y能使溴水褪色,且反应后的混合液静置后不分层 | |
| C. | Y不能发生取代反应 | |
| D. | Y分子中的所有原子一定共面 |
| A. | 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色 | |
| C. | 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成 | |
| D. | 向苯酚溶液中滴加几滴稀溴水出现白色沉淀 |

| A. | 碳 | B. | 硅 | C. | 银 | D. | 铝 |
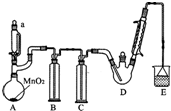 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流 写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行,为什么:CCl3COOH溶于乙醇与CCl3CHO.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.