题目内容
9.已知阿伏加德罗的值为NA.下列说法正确的是( )| A. | 28gN2与足量氢气反应,转移电子的数目为6NA | |
| B. | 500mL 0.1mol•L-1的MgSO4溶液中,阴离子所带负电荷数为0.1NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 2L0.2mol•L-1的稀硝酸与适量铁恰好反应(还原产物只有NO),生成NO的分子数为0.1 NA |
分析 A、氮气和氢气的反应为可逆反应;
B、MgSO4溶液中,阴离子除了硫酸根,还有OH-;
C、14CO2的摩尔质量为48g/mol;
D、根据铁与稀硝酸的反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O来分析.
解答 解:A、28g氮气的物质的量为1mol,而氮气和氢气的反应为可逆反应,故转移的电子的个数小于6NA个,故A错误;
B、MgSO4溶液中,阴离子除了硫酸根,还有OH-,故阴离子所带负电荷数大于0.1NA,故B错误;
C、标况下,22.4L14CO2的物质的量为1mol,而由于其摩尔质量为48g/mol,故44g14CO2的物质的量小于1mol,故含有的分子数小于NA个,故C错误;
D、根据铁与稀硝酸的反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,2L0.2mol/L硝酸的物质的量n=CV=0.2mol/L×2L=0.4mol,故生成的NO的物质的量为0.1mol即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列叙述错误的是( )
| A. | 任何可逆反应都有一定的反应限度 | B. | 反应达到限度即停止了 | ||
| C. | 化学反应限度与时间的长短无关 | D. | 化学反应限度是可以改变的 |
20.下列有关化学用语或名称正确的是( )
| A. | 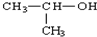 名称:2-甲基乙醇 名称:2-甲基乙醇 | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: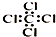 | D. | CH4Si的结构式: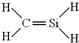 |
17.下列有关物质组成的说法正确的是( )
| A. | 物质均是由分子构成,分子均是由原子构成的 | |
| B. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| C. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 | |
| D. | 纯净的硫酸是纯净物,而纯净的盐酸是混合物 |
14.目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放食盐水,另一层存放镁和铁的混合物,使用时打开隔离层,食物即可被快速加热.下列对其工作原理分析不正确的是( )
| A. | 打开隔层后,形成了由食盐水、镁和铁构成的原电池 | |
| B. | 金属镁发生了氧化反应 | |
| C. | 铁是该原电池的负极 | |
| D. | 反应中涉及化学能、电能和热能的转化 |
1.有关油脂的下列说法正确的是( )
| A. | 油脂是高级脂肪酸和甘油形成的酯,属纯净物 | |
| B. | 油脂都不能与溴水反应 | |
| C. | 油脂的硬化属于酯化反应 | |
| D. | 天然油脂没有恒定的熔沸点 |
18.下列说法不正确的是( )
| A. | 利用油脂在碱性条件下水解可制取肥皂 | |
| B. | 煤的干馏是化学变化,煤的气化与液化是物理变化 | |
| C. | 纤维素属于天然高分子化合物,水解后可生成葡萄糖 | |
| D. | 石油裂解是深度裂化,其主要目的是为了得到乙烯、丙烯等基本化工原料 |
 已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:
已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下: