题目内容
19.下列离子方程式错误的是( )| A. | 证明醋酸的酸性比碳酸强:2CH3COOH+CaCO3═Ca2++H2O+2CH3COO-+CO2↑ | |
| B. | 证明FeCl2溶液已变质:Fe3++3SCN-═Fe(SCN)3 | |
| C. | 证明Al(OH)3有酸性:Al( OH)3+NH3•H2O═AlO2-+NH4++2H2O | |
| D. | 证明氧化性Fe3+>Cu2+:2Fe3++Cu═Cu2++2Fe2+ |
分析 A.发生强酸制取弱酸的反应;
B.变质生成铁离子,铁离子与KSCN结合生成络离子,溶液为血红色;
C.Al(OH)3有酸性,与强碱反应生成盐和水;
C.氧化剂的氧化性大于氧化产物的氧化性.
解答 解:A.2CH3COOH+CaCO3═Ca2++H2O+2CH3COO-+CO2↑为强酸制取弱酸的反应,可知醋酸的酸性比碳酸强,故A正确;
B.变质生成铁离子,铁离子与KSCN结合生成络离子,溶液为血红色,发生Fe3++3SCN-═Fe(SCN)3,可知变质,故B正确;
C.Al(OH)3有酸性,与强碱反应生成盐和水,与氨水不反应,故C错误;
C.2Fe3++Cu═Cu2++2Fe2+中氧化剂的氧化性大于氧化产物的氧化性,可知氧化性Fe3+>Cu2+,故D正确;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项C为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列有关化工生产的说法正确的是( )
| A. | 工业生产硫酸时,常用NaOH吸收尾气中的少量SO2 | |
| B. | 利用Fe3+作为混凝剂,可以对硬水进行软化 | |
| C. | N2与O2作用生成NO,属于氮的固定 | |
| D. | 石油的分馏、煤的气化或液化都是物理变化 |
4.下列有关钠的叙述中错误的是( )
| A. | 钠具有强还原性 | |
| B. | 金属钠可以保存在煤油中 | |
| C. | 钠的密度比水小 | |
| D. | 钠与硫酸铜溶液反应,可以置换出铜 |
11.1.68g碳粉与一定量的浓硫酸反应,生成CO2气体2.24L(标况下),则参加该反应的硫酸的物质的量为( )
| A. | 0.2mol | B. | 0.5 mol | C. | 0.56 mol | D. | 0.4 mol |
8.下列事故处理方法正确的是( )
| A. | 汽油失火时,立即用水灭火 | |
| B. | 电线短路失火时,用大量的水灭火 | |
| C. | 浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
9.一定条件下,通过下列反应可实现汽车尾气的合理排放:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0,若反应在恒容的密闭容器中进行,下列说法正确的是( )
| A. | 随着反应的进行,容器内压强始终不变 | |
| B. | 及时地分离出N2或CO2,正反应速率加快 | |
| C. | 升高温度(其它条件不变),可提高反应物的转化率 | |
| D. | 使用不同催化剂(其它条件不变),该反应的平衡常数不变 |
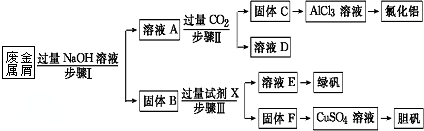
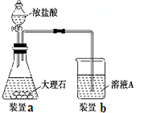 一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶