题目内容
 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)写出由①③⑧元素形成的既含离子键又含共价键的化合物电子式:
(2)④⑤⑥离子半径由小到大依次是
(3)含元素⑧的单质,在作自来的消毒剂时,能与自来水中的有机物反应生成对人体有害的物质,现已逐步淘汰,下列可代替它作自来水消毒剂的是
A.NH2C1 B.A1C13 C.K2FeO4 D.C1O2
(4)W与④是相邻的同主族元素,在下表中列出WO2的各种不同化学性质,举例并写出相应的化学方程式:
| 编号 | 性质 | 化学方程式或文字说明 |
| 示例 | 漂白性 | 与某些有色物质形成不稳定的无色物质 |
| Ⅰ | 还原性 | 2H2O+2SO2+O2=2HSO4 |
| Ⅱ | ||
| Ⅲ |
(5)由表中元素形成的常见物质X、Y、A、B,其中X、Y为化合物,A、B为同族元素组成的单质,它们之间可发生如图所示反应,写出其可能的化学方程式:
考点:元素周期律和元素周期表的综合应用,同一主族内元素性质递变规律与原子结构的关系,微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,
(1)由①③⑧元素中形成的既含离子键又含共价键的一种离子化合物为NH4Cl,由铵根离子与氯离子构成,溶液中铵根离子水解,溶液呈酸性;
(2)电子层结构相同,核电荷数越大离子半径越小;
(3)可代替氯气作自来水消毒剂的物质应具有氧化性;
(4)W与④是相邻的同主族元素,则W为S,SO2是酸性氧化物、具有氧化性、还原性、漂白性等;氧气氧化硫化氢生成硫与水,可以证明非金属性O>S;
(5)由表中元素形成的常见物质X、Y、A、B,其中X、Y为化合物,A、B为同族元素组成的单质,由转化关系可知为置换反应,应是碳与二氧化硅反应生成Si与CO或钠与水反应生成氢氧化钠与氢气.
(1)由①③⑧元素中形成的既含离子键又含共价键的一种离子化合物为NH4Cl,由铵根离子与氯离子构成,溶液中铵根离子水解,溶液呈酸性;
(2)电子层结构相同,核电荷数越大离子半径越小;
(3)可代替氯气作自来水消毒剂的物质应具有氧化性;
(4)W与④是相邻的同主族元素,则W为S,SO2是酸性氧化物、具有氧化性、还原性、漂白性等;氧气氧化硫化氢生成硫与水,可以证明非金属性O>S;
(5)由表中元素形成的常见物质X、Y、A、B,其中X、Y为化合物,A、B为同族元素组成的单质,由转化关系可知为置换反应,应是碳与二氧化硅反应生成Si与CO或钠与水反应生成氢氧化钠与氢气.
解答:
解:由元素在周期表中的位置可知①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,
(1)由①③⑧元素中形成的既含离子键又含共价键的一种离子化合物为NH4Cl,由铵根离子与氯离子构成,其电子式为: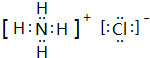 ,溶液中铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,
,溶液中铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,
故答案为: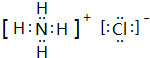 ;酸;
;酸;
(2)O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径Al3+<Na+<O2-,故答案为:Al3+<Na+<O2-;
(3)可代替氯气作自来水消毒剂的物质应具有氧化性,A中Cl元素为+1价,可水解生成HClO,C、D都具有强氧化性,可用于杀菌消毒,故答案为:ACD;
(4)W与④是相邻的同主族元素,则W为S,SO2具有还原性、漂白性等,还是酸性氧化物,可与氢氧化钠反应,方程式为SO2+2NaOH═Na2SO3+H2O,具有氧化性,与硫化氢反应生成S,方程式为2H2S+SO2═3S↓+2H2O,2H2S+O2═2S↓+2H2O可以说明非金属性O>S,
故答案为:
;2H2S+O2═2S↓+2H2O;
(6)由表中元素形成的常见物质X、Y、A、B,其中X、Y为化合物,A、B为同族元素组成的单质,由转化关系可知为置换反应,应是碳与二氧化硅反应生成Si与CO或钠与水反应生成氢氧化钠与氢气,反应方程式为:SiO2+2C
Si+2CO↑或2Na+2H2O=2NaOH+H2↑,
故答案为:SiO2+2C
Si+2CO↑或2Na+2H2O=2NaOH+H2↑.
(1)由①③⑧元素中形成的既含离子键又含共价键的一种离子化合物为NH4Cl,由铵根离子与氯离子构成,其电子式为:
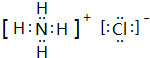 ,溶液中铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,
,溶液中铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,故答案为:
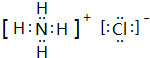 ;酸;
;酸;(2)O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径Al3+<Na+<O2-,故答案为:Al3+<Na+<O2-;
(3)可代替氯气作自来水消毒剂的物质应具有氧化性,A中Cl元素为+1价,可水解生成HClO,C、D都具有强氧化性,可用于杀菌消毒,故答案为:ACD;
(4)W与④是相邻的同主族元素,则W为S,SO2具有还原性、漂白性等,还是酸性氧化物,可与氢氧化钠反应,方程式为SO2+2NaOH═Na2SO3+H2O,具有氧化性,与硫化氢反应生成S,方程式为2H2S+SO2═3S↓+2H2O,2H2S+O2═2S↓+2H2O可以说明非金属性O>S,
故答案为:
| Ⅱ | 酸性氧化物 | SO2+2NaOH═Na2SO3+H2O |
| Ⅲ | 氧化性 | 2H2S+SO2═3S↓+2H2O |
(6)由表中元素形成的常见物质X、Y、A、B,其中X、Y为化合物,A、B为同族元素组成的单质,由转化关系可知为置换反应,应是碳与二氧化硅反应生成Si与CO或钠与水反应生成氢氧化钠与氢气,反应方程式为:SiO2+2C
| ||
故答案为:SiO2+2C
| ||
点评:本题考查较为综合,涉及元素周期表与无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合运用,难度中等,注意把握物质的性质,学习中注意积累.

练习册系列答案
相关题目
0.1mol?L-1 NH4Cl溶液的pH最接近于( )
| A、13 | B、7 | C、5.2 | D、1 |
下列说法不正确的是( )
| A、将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
| B、0.1mol?L-1的NaHCO3溶液中c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C、0.1mol?L-1的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2+)>c(H2A) |
| D、pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
 现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.
现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题. 近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前.“毒大米”是由镉污染引起的,会对人体健康造成严重危害.镉元素在元素周期表中的图示如图所示.
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前.“毒大米”是由镉污染引起的,会对人体健康造成严重危害.镉元素在元素周期表中的图示如图所示.