题目内容
5.下列离子方程式正确的是( )| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向NaHCO3溶液中加入过量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.氢氧化铁与HBr反应生成溴化铁和水;
C.硝酸根离子在酸性条件下能够氧化亚铁离子,该反应不满足电荷守恒和电子守恒;
D.氢氧化钡过量,反应产物中不会存在碳酸根离子.
解答 解:A.氯气通入水中,反应生成氯化氢和次氯酸,次氯酸需要保留分子式,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故A错误;
B.向Fe(OH)3中加入氢溴酸,反应的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O,故B正确;
C.向Fe(NO3)2稀溶液中加入盐酸,二者发生氧化还原反应,正确的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故C错误;
D.NaHCO3溶液中加入过量的Ba(OH)2溶液,反应生成碳酸钡沉淀、氢氧化钠和水,正确的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
3.完成下列实验所选择的装置或仪器不能达到实验目的是( )
| A. |  制取蒸馏水 | B. |  制取NH3 | C. |  收集NO2 | D. |  分离水和酒精 |
13.下列说法正确的是( )
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键,叫共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 含有离子键的化合物不一定是离子化合物 |
20.下列物质能使KMnO4酸性溶液褪色,不能使溴水褪色的是( )
| A. | 苯 | B. | 丙烯 | C. | 二甲苯 | D. | 己烷 |
10.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 高压比常压有利于工业合成氨反应 | |
| C. | 红棕色NO2加压后颜色比原来要深 | |
| D. | 热的纯碱除油污效果好 |
14.下列7种物质中,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色的是( )
①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2 .
①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2 .
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
 ;
; ;
;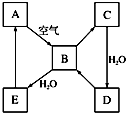 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.