题目内容
13.下列说法正确的是( )| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键,叫共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 含有离子键的化合物不一定是离子化合物 |
分析 A.共价化合物中一定不含有离子键;
B.相邻原子间强烈的相互作用是化学键,离子键是由阴阳离子通过静电作用形成的;
C.含有共价键的化合物中也可能含有离子键;
D.含有离子键的化合物一定是离子化合物.
解答 解:A.因含离子键的化合物一定为离子化合物,则共价化合物中一定不含有离子键,故A正确;
B.离子键是由离子形成的,即阴阳离子之间通过静电作用(既有吸引也有排斥)形成离子键,相邻原子间强烈的相互作用是化学键,故B错误;
C.含有共价键的化合物中也可能含有离子键,如NaOH,故C错误;
D.含有离子键的化合物一定是离子化合物,故D错误;
故选A.
点评 本题考查化学键、离子化合物、共价化合物,明确概念及概念的关系是解答本题的关键,并学会利用实例来说明问题,题目难度不大.

练习册系列答案
相关题目
11.已知115号元素的一种核素为289X,下列有关115号元素的有关叙述正确的是( )
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
8.亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.
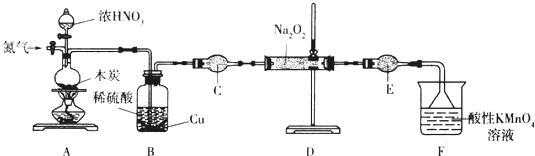
已知:①2NO+Na2O2═2NaNO2;
②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是ac(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液pH>7,说明NO2-离子水解程度大于HNO2的电离程度.

已知:①2NO+Na2O2═2NaNO2;
②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶(填操作名称)、过滤可获得CuSO4•5H2O.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸溶液中有气泡产生且在试管口上方出现红棕色气体,则产物是NaNO2(注明试剂、现象).
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KmnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液pH>7,说明NO2-离子水解程度大于HNO2的电离程度.
5.下列离子方程式正确的是( )
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向NaHCO3溶液中加入过量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
2.钛被誉为“21世纪金属”,具有多种优良性能,工业上冶炼金属钛的反应原理为4Na+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl.下列说法正确的是( )
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
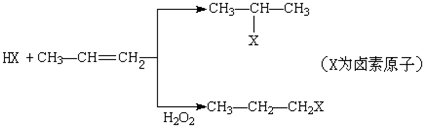
 的物质,该物质是一种香料.
的物质,该物质是一种香料.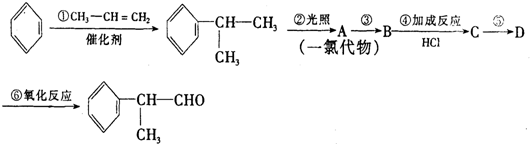
 ,
,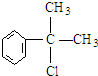 .
.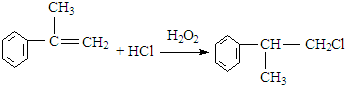 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):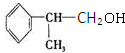 +NaCl.
+NaCl.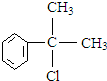 的水解产物
的水解产物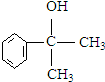 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: