题目内容
有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满.
(1)写出四种元素的元素符号.
A: ,B: ,C: ,D: .
(2)写出D元素基态原子核外电子排布的轨道表示式.D: ,
(3)写出B、C两种元素单质在一定条件下反应的化学方程式: .
(4)写出B元素单质和氢化物的分子式.单质: ,氢化物: .
(1)写出四种元素的元素符号.
A:
(2)写出D元素基态原子核外电子排布的轨道表示式.D:
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:
(4)写出B元素单质和氢化物的分子式.单质:
考点:位置结构性质的相互关系应用
专题:
分析:有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数大于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素,据此解答.
解答:
解:有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅占据一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数等于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素,
(1)由上述分析可知,A为H,B为N,C为Mg,D为P,故答案为:H;N;Mg;P;
(2)D为P元素,基态原子的电子排布图为: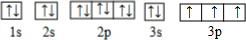 ,故答案为:
,故答案为: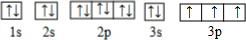 ;
;
(3)镁在氮气中燃烧生成二氮化三镁,反应方程式为:3Mg+N2
Mg3N2,故答案为:3Mg+N2
Mg3N2;
(4)B为氮元素,单质为N2、氢化物为NH3,故答案为:N2;NH3.
(1)由上述分析可知,A为H,B为N,C为Mg,D为P,故答案为:H;N;Mg;P;
(2)D为P元素,基态原子的电子排布图为:
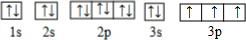 ,故答案为:
,故答案为: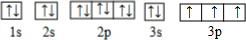 ;
;(3)镁在氮气中燃烧生成二氮化三镁,反应方程式为:3Mg+N2
| ||
| ||
(4)B为氮元素,单质为N2、氢化物为NH3,故答案为:N2;NH3.
点评:本题考查结构性质位置关系、核外电子排布规律等,难度不大,掌握核外电子排布规律是推断的关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
某链状有机物M由碳、氢、氧三种元素组成,其相对分子质量为74,要使M中氢原子数最少,下列说法正确的是( )
| A、一个M的分子中有38个电子 |
| B、M中一定含有醛基和羧基 |
| C、M不存在链状的同分异构体 |
D、M的结构式为  |
2014年“世界水日”和“世界水周”的活动主题为“加强合乎管理,建设生态文明”下列关于水的说法正确的是( )
| A、为了保护水资源,禁止使用化肥 |
| B、用电解大量水的方法获得清洁能源氧气 |
| C、4℃时,纯水的pH=7 |
| D、城市浇花,采用喷灌、滴滴灌技术 |
下列叙述正确的是( )
| A、氯气的水溶液可以导电,氯气是电解质 |
| B、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+ )增大 |
| C、升高温度,可逆反应的化学平衡常数一定增大 |
| D、在 CH3COONa 溶液中加入适量 CH3COOH,可使 c( Na+)=c(CH3COO-) |
 A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,C元素原子的最外层电子数是其内层电子数的3倍,D元素的主族序数等于其周期数,E元素原子的最外层电子数是其电子层数的2倍,G单质是日常生活中用量最大的金属,易被腐蚀,试回答下列问题:
A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,C元素原子的最外层电子数是其内层电子数的3倍,D元素的主族序数等于其周期数,E元素原子的最外层电子数是其电子层数的2倍,G单质是日常生活中用量最大的金属,易被腐蚀,试回答下列问题: 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: