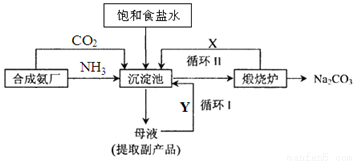
题目内容
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2 、CuSO4的混合溶液,并产生NO气体。则最终消耗的硝酸的物质的量是
A.12mo1 B.15mo1 C.16mo1 D.17mo1
A
【解析】
试题分析:144克FeO的物质的量=144g÷72g/mo=2mol,反应中Cu元素化合价由+1价升高为+2价,S元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,根据电子转移守恒:(5-2)×n(NO)=1mol×[2×(2-1)+6-(-2)]+2mol×(3-2),解得n(NO)=4mol,则作为氧化剂反应的HNO3为4mol,Cu2S为1mol,则生成的CuSO4为1mol,Cu(NO3)2为1mol,Fe(NO3)3为2mol,起酸性作用的HNO3为1mol×2+2mol×3=8mol,所以最终消耗的硝酸的物质的量=4mol+8mol=12mol,故A项正确。
考点:本题考查氧化还原反应的计算。

练习册系列答案
相关题目
 cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是

 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。