题目内容
(9分)
氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
(1)下面是利用氮气的一种途径

①步骤I中主要利用N2与液态空气中其它成分的________(填性质)不同。
②最新研究发现在碱性溶液中通过电解反应2N2+6H2O 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
(2)氨气可以用于侯氏制碱法,其流程如下图所示:
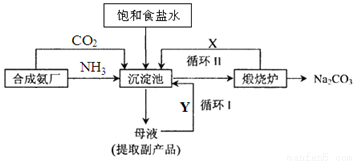
①循环I、II中循环利用的物质X是_________,Y是__________。(填化学式)
②向沉淀池中通入气体时,需要先通入NH3,再通入CO2,其原因是______________。
(9分)
(1)①沸点 (2分) ②N2+6e-+6H2O=2 NH3+6OH-(2分)
(2)①CO2、NaCl(2分)
②先通入溶解度大的NH3,使溶液呈碱性,增强CO2的溶解度(2分
【解析】
试题分析:(1)①N2与液态空气中其它成分的沸点不同,沸点低的先挥发。
②阴极N2得到电子,化合价升高,发生还原反应,阳极OH-失去电子发生氧化反应,所以阴极上发生的电极反应式为:N2+6e-+6H2O=2 NH3+6OH-。
(2)①碳酸氢钠煅烧生成碳酸钠、水、二氧化碳,所以X是二氧化碳(CO2);过滤除去析出的碳酸氢钠,溶液中还有部分碳酸氢钠未析出,是碳酸氢钠的饱和溶液,还有溶解在溶液中未析出的NaCl、NH4Cl、NH4HCO3,NaCl可循环使用,所以Y是NaCl。
②氨气在水中的溶解度较大,氨气能与二氧化碳反应,增大CO2的溶解度,所以需要先通入NH3,再通入CO2。
考点:本题考查化学流程的分析、方程式的书写、电解原理。

练习册系列答案
相关题目
