题目内容
含有较多Ca2+、Mg2+和HCO
的水称为暂时硬水,加热可除去Ca2+、Mg2+,使水变为软水.现有一锅炉厂使用这种水,试判断其水垢的主要成分为( ) (已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=5.6×10-12)
- 3 |
| A、CaO、MgO |
| B、CaCO3、MgCO3 |
| C、CaCO3、Mg(OH)2 |
| D、CaCO3、MgO |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:暂时硬水中存在Ca(HCO3)2和Mg(HCO3)2,Ca(HCO3)2受热时分别分解成CaCO3,因Mg(OH)2溶度积较小,则加热时水解,转化成溶度积较小的Mg(OH)2,这两种白色固体在容器内壁上积淀,即形成水垢,以此解答该题.
解答:
解:暂时硬水中存在Ca(HCO3)2和Mg(HCO3)2,Ca(HCO3)2受热时分别分解成CaCO3,因Mg(OH)2溶度积较小,则加热时水解,HCO3-水解,生成溶度积较小的Mg(OH)2,则水垢的主要成分为CaCO3、Mg(OH)2,
故选C.
故选C.
点评:本题考查难溶电解质的溶解平衡,为高频考点,侧重于化学于生活的考查,有利于培养学生的分析能力以及良好的科学素养,题目考查的侧重点为难溶电解质的溶解平衡,答题时注意体会,难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,1 mol CO2和CO的混合气中含有的氧原子数为1.5NA |
| B、常温常压下,33.6 L 氯化氢气体中含有的分子数为1.5NA |
| C、12g Mg与足量二氧化碳反应转移的电子数为NA |
| D、1 mol?L-1 CuCl2溶液中含有的氯离子数为2NA |
下列氧化物的稳定性前者比后者强的是( )
| A、CO和CO2 |
| B、GeO和GeO2 |
| C、SnO和SnO 2 |
| D、PbO和PbO2 |
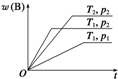 密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中进行的可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B、T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C、T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D、T1>T2,p1>p2,a+b>c,正反应为放热反应 |
向恒温恒容密闭容器中加入1molHI,发生下列反应2HI(g)═H2(g)+I2(g),△H>0.达到平衡后,往容器中再加入1molHI,有关说法正确的是( )
| A、平衡不移动,HI平衡转化率不变 |
| B、平衡向右移动,HI平衡转化率不变 |
| C、平衡向左移动,HI平衡转化率减小 |
| D、平衡向右移动,HI平衡转化率增大 |

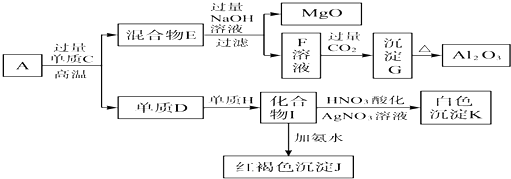
 A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示.A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似.
A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如图所示.A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似.