题目内容
3. 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | 若X位于第VA族,则沸点:XH3<WH3 |
分析 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期,
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
C.W处于第三周期,可能处于ⅣA族或ⅤA或ⅥA族,最高正价=族序数,最低负化合价=族序数-8;
D.若X位于第VA族,X为N,氨气分子间含氢键.
解答 解:A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径大小为Z>W>X>Y,故A错误;
B.同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,故C正确;
D.若X位于第VA族,X为N,氨气分子间含氢键,则沸点为XH3>WH3,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 | |
A | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
|
B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 | |
C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 | |
D | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 | |
| A. | 氯乙烯和聚乙烯均能发生加成反应 | |
| B. |  和 和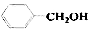 互为同系物 互为同系物 | |
| C. | 用新制氢氧化铜悬浊液能鉴别葡萄糖和乙酸 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
| A. | 淀粉、纤维素没有甜味,因此不属于糖类 | |
| B. | 所有的油脂都能使溴水褪色 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应 |
| A. | 原子序数:A>D>B>C | B. | 原子半径:D>B>C>A | ||
| C. | 原子序数:C>D>B>A | D. | 简单离子半径:A>B>C>D |
| A. | 鉴别1-溴丙烷和2-溴丙烷能通过核磁共振仪鉴别,不能用红外光谱仪鉴别 | |
| B. | 仅用物理方法无法鉴别乙醇、甲苯、硝基苯 | |
| C. | 仅用一种试剂能鉴别乙醇、苯、苯酚、2-己烯和四氯化碳 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
| A. | N2的结构式:N≡N | B. | CO2的电子式: | ||
| C. | NH3的形成过程: | D. | CaF2的电子式: |

