题目内容
8.A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层.下列叙述正确的是( )| A. | 原子序数:A>D>B>C | B. | 原子半径:D>B>C>A | ||
| C. | 原子序数:C>D>B>A | D. | 简单离子半径:A>B>C>D |
分析 A、B、C、D是四种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B、C、D同周期,均处于第三周期,B的阳离子比C的阴离子少一个电子层,则B为金属元素、C非金属元素,B的阳离子比D的阳离子氧化性强,则金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数D<B<C,以此来解答.
解答 解:A、B、C、D是4种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B、C、D同周期,均处于第三周期,B的阳离子比C的阴离子少一个电子层,则B为金属元素、C非金属元素,B的阳离子比D的阳离子氧化性强,则金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数D<B<C.
A.由上述分析可知,原子序数为C>B>D>A,故A错误;
B.同周期从左到右元素原子半径逐渐减小,同主族从上到下原子半径逐渐增大,故原子半径:D>B>C>A,故B正确;
C.由上述分析可知,原子序数为C>B>D>A,故C错误;
D.A、B、D离子的核外电子排布相同,C离子的核外电子排布比A、B、C的离子多一个电子层,电子层数越多,离子半径越大,故C阴离子半径最大,核外电子排布相同时,核电荷数越大,离子的半径越小,原子序数:B>D>A,所以离子半径:C>A>D>B,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构、氢化物稳定性、离子的氧化性为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 30 g乙烷中含共用电子对总数为8NA | |
| C. | 常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
3. 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | 若X位于第VA族,则沸点:XH3<WH3 |
13.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为16,Z原子的最外层电子数等于其电子层数,Y与W处于同一主族,X的原子半径小于Y.下列说法正确的是( )
| A. | Z的氧化物属于碱性氧化物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | W的氧化物对应的水化物一定是强酸 |
20.下列物质在变化过程中,化学键没有被破坏的是( )
| A. | 干冰升华 | B. | 食盐溶解 | ||
| C. | 氯化铵受热,固体消失 | D. | 电解水 |
17.有机物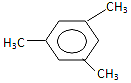 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )
 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )| A. | 间三甲苯 | B. | 1,3,5-三甲苯 | C. | 三甲苯 | D. | 1-3-5,三甲苯 |
4.对于苯乙烯(  )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )
 )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面.其中正确的是( )| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①②⑤⑥ | D. | 全部正确 |
 .
.