题目内容
14.某化学课外兴趣小组为探究铜与浓硫酸的反应,用如图所示的装置进行实验:
请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol•L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,实验中若有m g铜参加了反应,则有$\frac{m}{64}$mol硫酸被氧化,电子转移数目为$\frac{m}{32}$mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是D(填写字母编号).
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是稀硫酸不与铜反应.
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?方案一产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出);方案二沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的.
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)$\frac{V}{22.4×0.012}$mol/L.
分析 (1)铜和浓硫酸加热一生成二氧化硫气体,二氧化硫比空气重,用向上排气法收集,进气的导气管长进短处;
(2)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;依据化学方程式中元素化合价变化计算氧化还原关系;
②证明硫酸剩余是证明氢离子的存在;
③浓硫酸随反应进行浓度变稀后不与铜发生反应;
(3)方案一,碱石灰增重为二氧化硫和水蒸气的质量分析;
方案二,硫酸钡沉淀是二氧化硫被氧化为硫酸生成的硫酸钡沉淀和硫酸酸化高锰酸钾溶液,气酸化作用的硫酸生成的硫酸钡沉淀;
方案三,依据生成氢气计算硫酸物质的量结合浓度概念计算剩余硫酸浓度.
解答 解:(1)铜和浓硫酸加热一生成二氧化硫气体,二氧化硫比空气重,用向上排气法收集,进气的导气管长进短处,图中补进气管伸入近集气瓶底,装置图为: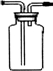 ,故答案为:
,故答案为: ;
;
(2)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;分析化学方程式若有m g铜物质的量为$\frac{m}{64}$mol参加了反应,被还原硫酸物质的量为$\frac{m}{64}$mol,电子转移物质的量为$\frac{m}{64}$mol×2=$\frac{m}{32}$,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;$\frac{m}{64}$;$\frac{m}{32}$;
②能证明反应停止后烧瓶中有硫酸剩余,只能证明氢离子的存在才能说明,不能证明硫酸根离子,因为浓硫酸和铜反应生成了硫酸铜;
A.硫酸钠溶液不能能证明硫酸根离子存在,也不能证明氢离子的存在,故A不符合;
B.氯化钡溶液能证明硫酸根离子存在,但不能证明氢离子存在,故B不符合;
C.银粉和稀硫酸不反应不能证明氢离子的存在,故C不符合;
D.碳酸钠溶液和氢离子反应生成二氧化碳气体,可以用来证明溶液中存在稀硫酸,故D符合;
故答案为:D;
③有一定量的硫酸剩余但未能使铜片完全溶解,因为浓硫酸随反应进行浓度变稀后不与铜发生反应,
故答案为:稀硫酸不与铜反应;
(3)方案一:铜和浓硫酸反应生成的二氧化硫气体中含有水蒸气,碱石灰吸收的质量为二氧化硫和水蒸气,或装置中二氧化硫未被完全排除,称量的不全是二氧化硫质量,故答案为:产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出);
方案二:生成的沉淀是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的沉淀和二氧化硫被氧化为硫酸生成的硫酸钡沉淀,不全是二氧化硫转化为硫酸生成的沉淀,
故答案为:沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的;
方案三:依据化学方程式Zn+H2SO4=ZnSO4+H2↑,生成氢气物质的量=$\frac{V}{22.4}$mol,所以剩余稀硫酸浓度=$\frac{V}{22.4×0.012}$mol/L,
故答案为:$\frac{V}{22.4×0.012}$mol/L.
点评 本题以浓硫酸性质的实验验证方法和过程分析判断,产物的验证方法分析应用,注意浓硫酸随反应进行变为稀硫酸后不与铜发生反应,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 油脂属于酯类 | |
| B. | 天然油脂没有固定的熔、沸点 | |
| C. | 油脂是高级脂肪酸的甘油酯 | |
| D. | 单甘油酯是纯净物,有固定的熔、沸点,混合甘油酯是混合物,没固定的熔、沸点 |
 室温下,用相同浓度的NaOH溶液,分别滴定等体积,浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示.下列判断正确的是( )
室温下,用相同浓度的NaOH溶液,分别滴定等体积,浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示.下列判断正确的是( )| A. | 三种酸的强弱顺序:HA<HB<HD | |
| B. | 滴定至P点时,溶液中:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗NaOH溶液的体积:HA<HB<HD | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)═c(OH-) |
| A. | M的实验式为CH2O | |
| B. | 若要得到M的分子式,还需要测得M的相对分子质量或物质的量 | |
| C. | 若M的相对分子质量为60,则M一定为乙酸 | |
| D. | 通过红外光谱仪可分析M中的官能团 |
①蒸馏普通酒精制无水乙醇;
②苯与浓硫酸混合加热至60℃制硝基苯;
③用苯和溴水混合制溴苯;
④用酸性KMnO4溶液分离甲烷和乙烯.
| A. | 只有①和④ | B. | 只有①和③ | C. | 只有①②③ | D. | ①②③④ |
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | 若X位于第VA族,则沸点:XH3<WH3 |

 .
.