题目内容
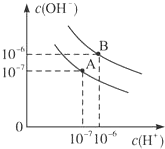 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
(2)95℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;
(2)先根据温度和混合溶液pH大小确定溶液的酸碱性,根据溶液的pH计算酸和碱的体积之比;
(3)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系.
(2)先根据温度和混合溶液pH大小确定溶液的酸碱性,根据溶液的pH计算酸和碱的体积之比;
(3)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系.
解答:
解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
故答案为:A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)95°C时纯水的pH=6,混合溶液的pH=7,说明酸、碱混合时碱过量溶液呈碱性,pH=9的NaOH溶液c(OH-)=10-3 mol/L,pH=4的H2SO4溶液(H+)=10-4mol/L,
设酸的体积为x,碱的体积为y,c(OH-)=
=10-5 mol/L,x:y=1:9;
答:碱的体积必是酸的9倍;
(3)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12.现强碱的OH-浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即pH1+pH2=14,或a+b=14.
故答案为:A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)95°C时纯水的pH=6,混合溶液的pH=7,说明酸、碱混合时碱过量溶液呈碱性,pH=9的NaOH溶液c(OH-)=10-3 mol/L,pH=4的H2SO4溶液(H+)=10-4mol/L,
设酸的体积为x,碱的体积为y,c(OH-)=
| 10-3y-10-4x |
| x+y |
答:碱的体积必是酸的9倍;
(3)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12.现强碱的OH-浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即pH1+pH2=14,或a+b=14.
点评:本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列变化中,吸收的热量用于克服分子间作用力的是( )
| A、加热融化金属铜 |
| B、液氯受热蒸发 |
| C、加热分解碘化氢 |
| D、加热融化硅晶体 |
保存下列试剂时,不需使用棕色试剂瓶的是( )
| A、NaHCO3 |
| B、浓硝酸 |
| C、氯水 |
| D、AgBr |
下列实验装置中能达到实验目的是( )
A、 以NH4Cl为原料,如图装置可用于实验室制备少量NH3 |
B、 如图装置装满水后由b口进气可收集H2、NO等气体 |
C、 如图装置可用于制取、收集NO2 |
D、 如图装置可用于除去Cl2中的HCl |
关于111号元素Rg的名称以及在元素周期表中的位置,正确的是( )
| A、錀 第七周期第ⅠB族 |
| B、镭 第七周期第ⅡA族 |
| C、金 第六周期第ⅠB族 |
| D、鎶 第七周期第ⅡB族 |
 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.