题目内容
保存下列试剂时,不需使用棕色试剂瓶的是( )
| A、NaHCO3 |
| B、浓硝酸 |
| C、氯水 |
| D、AgBr |
考点:化学试剂的存放
专题:化学实验基本操作
分析:见光易分解的药品要保存在棕色试剂瓶中,如浓硝酸、新制的氯水、溴化银等,不需使用棕色试剂瓶,说明该试剂见光不分解,如碳酸氢钠、氢氧化钠等,据此进行解答.
解答:
解:A.碳酸氢钠受热容易分解,但是见光不分解,不需要不存在棕色试剂瓶中,故A错误;
B.浓硝酸见光易分解生成二氧化氮、水和氧气,所以要保存在棕色试剂瓶中,故B正确;
C.氯水中含有次氯酸,次氯酸见光容易分解,需要避光保存,通常通常在棕色试剂瓶中,故C错误;
D.溴化银具有较强感光性,见光易分解,需要不存在棕色试剂瓶中,故D错误;
故选A.
B.浓硝酸见光易分解生成二氧化氮、水和氧气,所以要保存在棕色试剂瓶中,故B正确;
C.氯水中含有次氯酸,次氯酸见光容易分解,需要避光保存,通常通常在棕色试剂瓶中,故C错误;
D.溴化银具有较强感光性,见光易分解,需要不存在棕色试剂瓶中,故D错误;
故选A.
点评:本题考查了常见化学试剂的保存方法判断,题目难度不大,注意掌握常见化学试剂的性质及正确保存方法,明确见光易分解的物质需要保存在棕色试剂瓶中.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
能大量共存于同一溶液中的离子组是( )
| A、N03-、HC03-、H+ |
| B、Na+、N03-、Cl- |
| C、H+、K+、OH- |
| D、S042-、Na+、Ba2+ |
下列有机物中,既能发生消去反应,又能发生取代反应和酯化反应的是( )
A、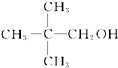 |
| B、CH3CH2CH2CH2Cl |
| C、HO-CH2-CH2-COOH |
| D、Cl-CH2-COOH |
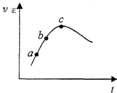 向绝热恒容密闭容器中通入气体A和B,一定条件下:A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,其正反应速率随时间变化的示意图如图所示.下列说法正确的是( )
向绝热恒容密闭容器中通入气体A和B,一定条件下:A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,其正反应速率随时间变化的示意图如图所示.下列说法正确的是( )| A、反应体系中加入催化剂,反应速率增大,△H也增大 |
| B、反应物的浓度:a点小于b点 |
| C、反应在C点达到到平衡 |
| D、达到平衡后,想办法升温,A的转化率将减小 |
在下面哪些反应中浓硫酸既表现出强氧化性又表现出酸性( )
A、2NaCl+H2SO4(浓)
| ||||
B、Na2SO3+H2SO4(浓)
| ||||
C、C+2H2SO4(浓)
| ||||
D、Cu+2H2SO4(浓)
|
下列物质属于非电解质,但其水溶液能导电的是( )
| A、Fe |
| B、CH4 |
| C、NH3 |
| D、稀H2SO4 |
 (1)弱酸HA的电离常数 K=
(1)弱酸HA的电离常数 K=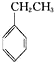 (g)+CO2(g)?
(g)+CO2(g)?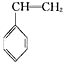 (g)+CO(g)+H2O(g)△H=-166kJ?mol-1
(g)+CO(g)+H2O(g)△H=-166kJ?mol-1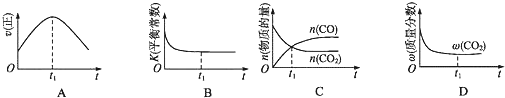
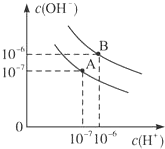 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: