题目内容
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
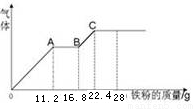
A.原混合液中NO3-的物质的量为0.4mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5mol·L-1
D
【解析】
试题分析:A、铜与混酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O,铜粉最多溶解19.2g,物质的量是19.2g/64g/mol=0.3mol,则硝酸全部做氧化剂,需要硝酸根离子的物质的量是0.2mol,所以原混合液中NO3-的物质的量为0.4mol,正确;B、在稀硝酸与稀硫酸的混合液中,加入铁粉,铁先与硝酸发生氧化还原反应,所以OA段产生是NO,硝酸根全部消耗完后,再加铁粉,由于铁离子的氧化性大于氢离子,此时AB段气体的量不变,所以此时发生的反应2Fe3++Fe = 3Fe2+,继续加入铁粉,则铁粉与氢离子反应生成氢气,正确;C、硝酸根全部被还原为NO,所以最终的溶液是硫酸亚铁溶液,正确;D、根据图像可知,加入22.4g铁粉时,气体不再增加,说明反应完全,生成硫酸亚铁的物质的量是22.4g/56g/mol=0.4mol,所以硫酸的物质的量浓度为0.4mol/0.1L=4mol/L,错误,答案选D。
考点:考查对图像的分析,金属与混酸的反应计算

练习册系列答案
相关题目
 2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是
2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是 H++OH— ΔH>0,下列叙述正确的是( )
H++OH— ΔH>0,下列叙述正确的是( )