题目内容
某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
为了鉴别上述化台物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸锁溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D .
(2)将含I mol A的溶液与含l molE的溶液反应后蒸于,仅得到一种化台物,该化合物的化学式为 .
(3)在A溶液中加入少量澄清石灰水,其离子方程式为 .
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理 .
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为 g.
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸锁溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B
(2)将含I mol A的溶液与含l molE的溶液反应后蒸于,仅得到一种化台物,该化合物的化学式为
(3)在A溶液中加入少量澄清石灰水,其离子方程式为
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有铜离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,只有B、C含有钾离子,所以E是氢氧化钠;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,C、D中产生白色沉淀,则C、D中含有硫酸根离子,所以D是硫酸铜,C是硫酸铝钾;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是硝酸钾,所以A是碳酸氢钠,以此来解答.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,只有B、C含有钾离子,所以E是氢氧化钠;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,C、D中产生白色沉淀,则C、D中含有硫酸根离子,所以D是硫酸铜,C是硫酸铝钾;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是硝酸钾,所以A是碳酸氢钠,以此来解答.
解答:
解:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有铜离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,只有B、C含有钾离子,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,C、D中产生白色沉淀,则C、D中含有硫酸根离子,所以D是硫酸铜,C是硫酸铝钾;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是硝酸钾,所以A是碳酸氢钠.
通过以上分析可知,A为NaHCO3,B为KNO3,C为KAl(SO4)2,D为CuSO4,E为NaOH,
(1)B为KNO3,D为CuSO4,故答案为:KNO3;CuSO4;
(2)将含1 mol 碳酸氢钠的溶液与含l mol氢氧化钠的溶液反应,两者恰好完全反应生成碳酸钠,故蒸于仅得到一种化台物的化学式为Na2CO3,故答案为:Na2CO3;
(3)在碳酸氢钠溶液中加入少量澄清石灰水,其离子方程式为:2HCO
+Ca2++2OH-=CaCO3↓+CO
+H2O,故答案为:2HCO
+Ca2++2OH-=CaCO3↓+CO
+H2O;
(4)KAl(SO4)2中铝离子为弱碱阳离子,容易水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附悬浮杂质的能力,故离子反应方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;水解生成的氢氧化铝胶体能吸附水中的悬浮物净水;
(5)若向含溶质lmolKAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大时未为硫酸根与钡离子恰好完全反应,即生成硫酸钡为2mol,质量为:2mol×233g/mol=466g,故答案为:466.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有铝离子,E中含有氢氧根离子;
③进行焰色反应实验,只有B、C含有钾离子,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有碳酸氢根离子,C、D中产生白色沉淀,则C、D中含有硫酸根离子,所以D是硫酸铜,C是硫酸铝钾;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是硝酸钾,所以A是碳酸氢钠.
通过以上分析可知,A为NaHCO3,B为KNO3,C为KAl(SO4)2,D为CuSO4,E为NaOH,
(1)B为KNO3,D为CuSO4,故答案为:KNO3;CuSO4;
(2)将含1 mol 碳酸氢钠的溶液与含l mol氢氧化钠的溶液反应,两者恰好完全反应生成碳酸钠,故蒸于仅得到一种化台物的化学式为Na2CO3,故答案为:Na2CO3;
(3)在碳酸氢钠溶液中加入少量澄清石灰水,其离子方程式为:2HCO
- 3 |
2- 3 |
- 3 |
2- 3 |
(4)KAl(SO4)2中铝离子为弱碱阳离子,容易水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附悬浮杂质的能力,故离子反应方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;水解生成的氢氧化铝胶体能吸附水中的悬浮物净水;
(5)若向含溶质lmolKAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大时未为硫酸根与钡离子恰好完全反应,即生成硫酸钡为2mol,质量为:2mol×233g/mol=466g,故答案为:466.
点评:本题主要考查的是常见阳离子的检验,熟练掌握元素化合物的性质是解题关键,属于高频考题.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列物质能与水反应生成强酸的是( )
| A、NH3 |
| B、CO2 |
| C、SO3 |
| D、Na2O |
根据下列化学实验事实得出的结论一定正确的是( )
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解.结论:该溶液中有SO42- |
| B、向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝.结论:该溶液中有NH4+ |
| C、向1 mL浓度均为0.05 mol?L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol?L-1的AgNO3溶液,振荡,沉淀呈黄色. 结论:Ksp(AgCl)<Ksp(AgI) |
| D、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀.结论:X中不含有醛基 |
现在加碘盐中加入的是( )
| A、碘单质 | B、碘酸钾 |
| C、碘化钾 | D、碘化银 |
下列实验目的能够实现的是( )
| A、用托盘天平称取5.68克Na2CO3固体 |
| B、用量筒量取30.26 ml液体 |
| C、向小试管中加入100 ml液体 |
| D、用胶头滴管取约1 ml液体 |
化学与能源开发、环境保护、资源利用、食品安全等密切相关.下列说法正确是( )
| A、自来水生产中应尽量用明矾净化、消毒 |
| B、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
| C、绿色化学的核心是利用化学反应原理治理环境污染 |
| D、高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 |
室温下,将10mL pH=2的CH3COOH溶液加水稀释至1L,pH为( )
| A、4 | B、>4 | C、<4 | D、无法判断 |
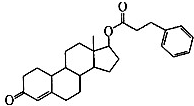 苯丙酸诺龙是一种兴奋剂,结构简式为:
苯丙酸诺龙是一种兴奋剂,结构简式为: