题目内容
3.下列说法中,正确的是( )①交警用酸性重铬酸钾检查司机饮酒过量时乙醇发生了取代反应
②伴随能量变化的过程都是化学变化
③在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同
④苯分子中没有乙烯分子中的双键结构,因此苯不能发生加成反应
⑤共价化合物中不可能含离子键
⑥构成分子的微粒中一定含有共价键.
| A. | ①⑥ | B. | ②④ | C. | ③⑤ | D. | ⑤⑥ |
分析 ①酸性重铬酸钾与乙醇发生氧化还原反应;
②物理变化也可能伴随能量变化;
③化学反应伴随能量的变化,则反应物的总能量与生成物的总能量一定不同;
④苯能发生加成反应;
⑤共价化合物只含有共价键;
⑥单原子分子不含共价键.
解答 解:①酸性重铬酸钾具有强氧化性,与乙醇发生氧化还原反应,故错误;
②物理变化也可能伴随能量变化,如水结冰放热,气化吸热,故错误;
③化学反应伴随能量的变化,则反应物的总能量与生成物的总能量一定不同,故正确;
④苯不含碳碳双键,但能发生加成反应,故错误;
⑤共价化合物只含有共价键,含有离子键,则为离子化合物,故正确;
⑥单原子分子不含共价键,如稀有气体,故错误.
故选C.
点评 本题考查较为综合,涉及有机物的结构和性质、共价键、化学反应与能量等知识,为高频考点,侧重于双基的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
10.下列有关氯元素及其化合物的表示正确的是( )
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: | |
| C. | 氯分子的电子式: | |
| D. | 氯化氢的结构式:H-Cl |
14.关于如图原电池装置的说法正确的是( )

| A. | Cu一定为正极 | |
| B. | 若溶液中的阴离子移向铁电极,则电流由铜电极经导线流向铁电极 | |
| C. | 若铜电极增重,则X可能为CuSO4、AgNO3、FeCl3等 | |
| D. | 若铜电极溶解,则铁电极表面可能有无色刺激性气味的气体产生 |
18.某有机物的结构简式如图所示,下列有关该物质的说法不正确的是( )


| A. | 该物质的分子式为C16H14O3 | |
| B. | 该物质分子中的所有碳原子可能共平面 | |
| C. | 滴人KMnO4(H+)溶液,可观察到紫色褪去,不能证明结构中存在碳碳双键 | |
| D. | 1mol该物质分别与NaOH、浓溴水和H2反应时最多消耗NaOH、Br2和H2分别为3mol、4mol、7mol |
15.标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b molNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量( )
| A. | $\frac{a}{2mol}$ | B. | $\frac{a}{22.4-b}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | $\frac{b}{2}$mol |
12.向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO42-的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.3 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后得到的金属单质为Cu |

 +(2n-1)H2O.
+(2n-1)H2O.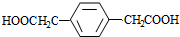 .
. .
.