题目内容
2.化学反应3Fe2++2S2O32-+O2+aOH-═Fe3O4+S4O62-+2H2O是水热法制备Fe3O4纳米颗粒的原理.下列说法正确的是( )| A. | 参加反应的Fe2+全部作还原剂 | |
| B. | 生成1.5molFe3O4时,反应转移电子 6mol电子 | |
| C. | 方程式中a=2 | |
| D. | 反应中被氧化的元素是Fe,被还原的元素是S和O |
分析 3Fe2++2S2O32-+O2+aOH-═Fe3O4+S4O62-+2H2O反应中4个S原子中S的化合价由+2升高为+2.5,O元素的化合价由0降低为-2,利用质量守恒及电子守恒和氧化还原反应的有关概念来分析.
解答 解:A.四氧化三铁中铁部分是亚铁,所以Fe2+部分作还原剂,故A错误;
B.生成1.5molFe3O4时,反应转移电子1.5×4=6mol电子,故B正确;
C.由电荷守恒可知a=4,故C错误;
D.S元素的化合价升高,则S2O32-是还原剂被氧化,故D错误;
故选B.
点评 本题考查氧化还原反应,元素的化合价判断是解答本题的关键,注意S元素的化合价是解答的难点,题目难度不大.

练习册系列答案
相关题目
12.下列有关1mol O2的说法中,不正确的是(NA表示阿伏加德罗常数)( )
| A. | 质量为32g | B. | 含氧原子数为NA | ||
| C. | 含氧分子数为NA | D. | 在标准状况下,体积约为22.4L |
10.下列过程中所发生的化学变化属于取代反应的是( )
| A. | 乙炔通入溴水中 | |
| B. | 乙烯通入酸性高锰酸钾溶液中 | |
| C. | 在镍作催化剂的条件下,苯与氢气反应 | |
| D. | 乙烷与氯气光照下发生反应 |
17.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在煤油或石蜡油中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
7.现有25℃的下列四种溶液,其中碱性最强的是( )
| A. | pH=11的溶液 | B. | 4 g NaOH溶于水形成1L的水溶液 | ||
| C. | c(OH-)=0.12 mol•L-1 | D. | c(H+)=1×10-10 mol•L-1的溶液 |
14.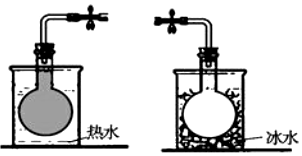 在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
 在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )| A. | 该反应的正反应为吸热反应 | |
| B. | 反应达到平衡时,再充入少量NO2,平衡后NO2的转化率增大 | |
| C. | 反应达到平衡时,再充入少量N2O4,气体颜色变浅 | |
| D. | 反应达到平衡时,增大压强,平衡向正反应方向移动,逆反应速率减小 |
12.向一无色溶液中加入BaCl2 溶液,生成不溶于硝酸的白色沉淀,则这溶液中( )
| A. | 一定含Ag+ | B. | 一定含SO42- | C. | 含有Ag+或SO42- | D. | 含有Ag+和SO42- |
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图: