题目内容
12.向一无色溶液中加入BaCl2 溶液,生成不溶于硝酸的白色沉淀,则这溶液中( )| A. | 一定含Ag+ | B. | 一定含SO42- | C. | 含有Ag+或SO42- | D. | 含有Ag+和SO42- |
分析 银离子与氯离子生成AgCl沉淀,钡离子与硫酸根离子生成沉淀,且AgCl、BaSO4均不溶于硝酸,以此来解答.
解答 解:无色溶液中加入BaCl2 溶液,生成不溶于硝酸的白色沉淀,则白色沉淀可能为AgCl或BaSO4,可知原溶液中可能含Ag+或SO42-,但二者不能同时存在,
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象与结论为解答的关键,侧重分析与实验能力的考查,注意常见的不溶于硝酸的白色沉淀,题目难度不大.

练习册系列答案
相关题目
2.化学反应3Fe2++2S2O32-+O2+aOH-═Fe3O4+S4O62-+2H2O是水热法制备Fe3O4纳米颗粒的原理.下列说法正确的是( )
| A. | 参加反应的Fe2+全部作还原剂 | |
| B. | 生成1.5molFe3O4时,反应转移电子 6mol电子 | |
| C. | 方程式中a=2 | |
| D. | 反应中被氧化的元素是Fe,被还原的元素是S和O |
3.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是CO32-.
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是C(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5;要使0.2mol•L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为6.
(1)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是C(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5;要使0.2mol•L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为6.
20.下列所述的操作中没有涉及到化学变化的是( )
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 熟石膏转化为生石膏 | |
| D. | 工业制液态氧 |
7.甲酸的下列性质中可以证明它是弱电解质的是( )
| A. | 1 mol/L的甲酸溶液中氢离子浓度约为10-2 mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10 mol/L甲酸恰好与10 mol/LNaOH溶液完全反应 | |
| D. | 在一定温度下,甲酸的导电性比盐酸溶液弱 |
17.测定胆矾晶体中结晶水含量的实验中,必须做恒重操作的原因是( )
| A. | 判定加热时有无晶体飞溅 | B. | 判断是否已失去全部结晶水 | ||
| C. | 判断是否有其他杂质 | D. | 防止失水后又吸潮 |
3.下列有关物质的性质与用途具有对应关系的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | NH4Cl受热易分解,可用作氮肥 | |
| C. | MgO熔点高,可用作耐高温材料 | |
| D. | KAl(SO4)2•12H2O易溶于水,可用作净水剂 |
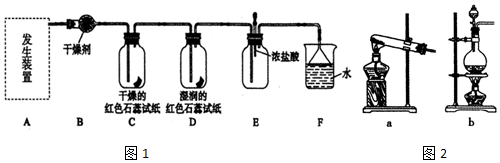
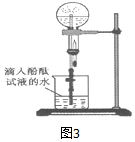


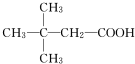 .(用结构简式表示)
.(用结构简式表示)