题目内容
制造干电池的主要原料之一是MnO2,工业上常用Mn(NO3)2和KMnO4为原料制备MnO2,其生产原理如下:用软锰矿(含MnO2和少量的Fe2O3、SiO2)和碳反应制得MnO;再将MnO与稀硝酸反应,反应后经过滤、提纯、浓缩,可制得50%的Mn(NO3)2溶液;在一定条件下,把50%的Mn(NO3)2溶液滴加到KMnO4溶液中,发生如下反应:3Mn(NO3)2+2KMnO4+2H2O═5MnO2↓+2KNO3+4HNO3,反应生成的沉淀经过滤、洗涤、干燥后得到MnO2.

请回答下列问题:
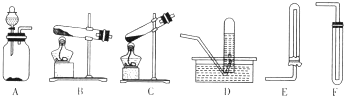
(1)若将软锰矿和碳反应后的固体产物置于如图1所示的装置甲中,与稀硝酸反应,观察到装置乙中有红棕色气体产生.
①写出甲中产生气体反应的化学方程式 .
②反应过程中,要向乙中通入一定量的空气,原因是 .
③装置丙试剂瓶中盛放的试剂是 .
(2)在制备MnO2的实验中要向反应混合液中不断滴加氨水,则氨水的作用是 .
(3)沉淀经过滤、洗涤、干燥后得到的固体,除主要含有MnO2外,还可能混有杂质,则该杂质可能是 (写化学式).
(4)有人提出用日光分解KMnO4溶液的方法可制取MnO2,反应方程式为:4KMnO4+2H2O
4MnO2↓+4KOH+3O2↑,该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是 .

请回答下列问题:
(1)若将软锰矿和碳反应后的固体产物置于如图1所示的装置甲中,与稀硝酸反应,观察到装置乙中有红棕色气体产生.
①写出甲中产生气体反应的化学方程式
②反应过程中,要向乙中通入一定量的空气,原因是
③装置丙试剂瓶中盛放的试剂是
(2)在制备MnO2的实验中要向反应混合液中不断滴加氨水,则氨水的作用是
(3)沉淀经过滤、洗涤、干燥后得到的固体,除主要含有MnO2外,还可能混有杂质,则该杂质可能是
(4)有人提出用日光分解KMnO4溶液的方法可制取MnO2,反应方程式为:4KMnO4+2H2O
| ||
考点:制备实验方案的设计
专题:实验题,元素及其化合物
分析:(1)软锰矿含有少量的Fe2O3,在加热条件下与C反应可生成铁,铁与稀硝酸反应生成NO气体,为便于吸收氮氧化物,应向乙中通入空气,空气中的氧气将NO氧化成NO2,使气体呈红棕色,丙中应盛NaOH溶液等碱性物质,吸收有毒气体NO2;
(2)制备MnO2的实验中生成HNO3,加入氨水,可以中和硝酸,增大反应物的转化率;
(3)由于在反应中不断加入氨水,则生成MnO2的同时可能生成Mn(OH)2;
(4)反应中c(OH-)在t1时突然增大,说明反应速率增大,在其它条件不变的情况下,可考虑生成物起到催化剂的作用.
(2)制备MnO2的实验中生成HNO3,加入氨水,可以中和硝酸,增大反应物的转化率;
(3)由于在反应中不断加入氨水,则生成MnO2的同时可能生成Mn(OH)2;
(4)反应中c(OH-)在t1时突然增大,说明反应速率增大,在其它条件不变的情况下,可考虑生成物起到催化剂的作用.
解答:
解:(1)①软锰矿含有少量的Fe2O3,在加热条件下与C反应可生成铁,铁与稀硝酸反应生成NO气体,反应的方程式为Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O,
故答案为:Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O;
②铁与稀硝酸反应生成NO,NO不能直接排放到空气中,且与水\NaOH溶液等物质不反应,为便于吸收,可通入氧气生成二氧化氮,以防止污染空气,
故答案为:把一氧化氮氧化成二氧化氮,便于尾气吸收充分,防止污染环境;
③丙中应盛放NaOH溶液,可与二氧化氮反应生成硝酸钠、亚硝酸钠,故答案为:NaOH溶液;
(2)制备MnO2的实验中生成HNO3,加入氨水,可以中和硝酸,增大反应物的转化率,使原料尽可能多的转化为MnO2,
故答案为:中和产生的HNO3,使原料尽可能多的转化为MnO2;
(3)由于在反应中不断加入氨水,则生成MnO2的同时,硝酸镁与氨水反应生成Mn(OH)2,故答案为:Mn(OH)2;
(4)反应中c(OH-)在t1时突然增大,说明反应速率增大,在其它条件不变的情况下,应是生成物MnO2起到催化剂的作用,
故答案为:反应生成的MnO2对该反应有催化作用.
故答案为:Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O;
②铁与稀硝酸反应生成NO,NO不能直接排放到空气中,且与水\NaOH溶液等物质不反应,为便于吸收,可通入氧气生成二氧化氮,以防止污染空气,
故答案为:把一氧化氮氧化成二氧化氮,便于尾气吸收充分,防止污染环境;
③丙中应盛放NaOH溶液,可与二氧化氮反应生成硝酸钠、亚硝酸钠,故答案为:NaOH溶液;
(2)制备MnO2的实验中生成HNO3,加入氨水,可以中和硝酸,增大反应物的转化率,使原料尽可能多的转化为MnO2,
故答案为:中和产生的HNO3,使原料尽可能多的转化为MnO2;
(3)由于在反应中不断加入氨水,则生成MnO2的同时,硝酸镁与氨水反应生成Mn(OH)2,故答案为:Mn(OH)2;
(4)反应中c(OH-)在t1时突然增大,说明反应速率增大,在其它条件不变的情况下,应是生成物MnO2起到催化剂的作用,
故答案为:反应生成的MnO2对该反应有催化作用.
点评:本题考查物质的制备,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的原理以及题给信息,为解答该题的关键,难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
关于电解NaCl水溶液,下列叙述正确的是( )
| A、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
| B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
| C、电解时在阳极得到氯气,在阴极得到金属钠 |
| D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
室温下,强酸性和强碱性溶液中都不能共存的离子组是( )
| A、NH4+、Ag+、Cl-、NO3- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、NO3-、SO42- |
| D、Ba2+、Fe2+、NO3-、Cl- |