题目内容
9.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 3.55gCl2通入足量水中充分反应,转移电子数为0.05NA | |
| B. | 18gNH4+含有质子数为10NA | |
| C. | 13.8gNO2与足量水反应时,转移电子的数目为0.2NA | |
| D. | 标准状况下,相同体积的SO3、HCl、NO含有的分子数相同 |
分析 A、氯气和水的反应为可逆反应;
B、求出铵根离子的物质的量,然后根据1mol铵根离子中含11mol质子来分析
C、求出二氧化氮的物质的量,然后根据3mol二氧化氮转移2mol电子来分析;
D、标况下三氧化硫为固体.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.05NA个,故A错误;
B、18g铵根离子的物质的量为1mol,而1mol铵根离子中含11mol质子即11NA个,故B错误;
C、13.8g二氧化氮的物质的量为n=$\frac{13.8g}{46g/mol}$=0.3mol,而3mol二氧化氮转移2mol电子,故0.3mol二氧化氮转移0.2mol电子即0.2NA个,故C正确;
D、标况下三氧化硫为固体,故三氧化硫的物质的量不能根据气体摩尔体积来计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列原子外围电子层的电子排布图正确的是( )
| A. | O  | B. | Fe  | C. | Si  | D. | Cr |
20.氯化溴是由两种卤素互相结合而成的卤素互化物.其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O═HCl+HBrO,下列有关BrCl的性质的叙述中不正确的是( )
| A. | BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 | |
| B. | BrCl具有较强的氧化性 | |
| C. | 能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | BrCl与水反应中,BrCl既是氧化剂又是还原剂 |
17.下列物质中不属于合金的是( )
| A. | 金刚石 | B. | 白铜 | C. | 硬铝 | D. | 不锈钢 |
14.实验室中可用如下反应制取氯气:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O有关判断正确的是( )
| A. | 氧化性:KMnO4<Cl2 | |
| B. | 500mL12.8mol/L的盐酸与足量的KMnO4反应,可生成1.6 molCl2 | |
| C. | 此反应中氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 实验室使用硫酸而不用盐酸酸化高锰酸钾,因为盐酸会被高锰酸钾氧化 |
19.下列解释事实的方程式正确的是( )
| A. | 钢铁生锈,负极反应式为Fe-3e-═Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2O2↑ | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
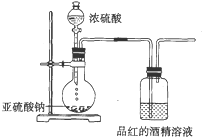 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.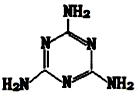 有机物三聚氰胺的结构如图所示:
有机物三聚氰胺的结构如图所示: