题目内容
19.下列原子外围电子层的电子排布图正确的是( )| A. | O  | B. | Fe  | C. | Si  | D. | Cr |
分析 A、洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同;
B、基态铁原子外围电子排布式为3d64s2;
C、洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道;
D、基态Cr原子外围电子排布式为3d54s1.
解答 解:A、2p轨道两个单电子自旋方向应相同,故A错误;
B、基态铁原子外围电子排布式为3d64s2,外围电子排布图为: ,故B正确;
,故B正确;
C、洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,所以3p轨道2个电子应分占两个轨道,且自旋方向相同,故C错误;
D、基态Cr原子外围电子排布式为3d54s1,而不是3d44s2,故D错误;
故选B.
点评 本题考查原子核外电子排布规律及排布式和排布图的书写,题目难度不大,本题注意原子核外电子的排布和运动特点.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
7.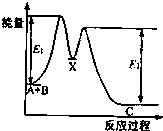 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
14.下列各组物质性质的比较中,错误的是( )
| A. | 还原性:HF<HCl<H2S | B. | 金属性:Na>Mg>Be | ||
| C. | 非金属性:F>Cl>S | D. | 离子半径:Al3+>Mg2+>F- |
4.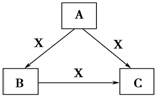 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
8.在水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、CO32- | D. | K+、NO3-、OH-、SO42- |
9.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 3.55gCl2通入足量水中充分反应,转移电子数为0.05NA | |
| B. | 18gNH4+含有质子数为10NA | |
| C. | 13.8gNO2与足量水反应时,转移电子的数目为0.2NA | |
| D. | 标准状况下,相同体积的SO3、HCl、NO含有的分子数相同 |



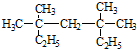 系统命名法为3,3,5,5-四甲基庚烷,
系统命名法为3,3,5,5-四甲基庚烷, ,
,