题目内容
18.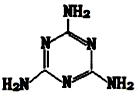 有机物三聚氰胺的结构如图所示:
有机物三聚氰胺的结构如图所示:(1)分子中各元素的第一电离能由大到小的顺序是N>C>H.
(2)推测其分子的水溶性并说明原因能溶于水因为三聚氰胺分子与水分子间能形成氢键.
(3)分子中N原子的杂化类型为sp2和sp3
(4)分子中所有的N原子是在同一平面(填“是”或“否”)
分析 (1)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)三聚氰胺与水分子间形成氢键;
(3)根据N原子的价层电子对数判断;
(4)根据N原子的杂化类型判断,分子的空间构型;
解答 解:(1)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>C,氢的第一电离能最小,故答案为:N>C>H;
(2)分子中含有H-N、H-O的化合物能与水分子间形成氢键,三聚氰胺与水分子间形成氢键,所以三聚氰胺分子的水溶性好,故答案为:能溶于水因为三聚氰胺分子与水分子间能形成氢键;
(3)由有机物三聚氰胺结构图可知,分子中N原子形成的化学键为C=N和C-N,形成C=N时,N原子中含有3个价层电子对杂化类型为sp2;形成C-N时,N原子中含有4个价层电子对,杂化类型为sp3,
故答案为:sp2和sp3;
(4)由有机物三聚氰胺结构图可知,六元环上的N原子都是以C=N形式存在,属于sp2杂化,分子的空间构型为平面形,所以分子中所有的N原子在同一平面上;
故答案为:是.
点评 本题考查了物质结构和性质,涉及第一电离能、原子的杂化方式、氢键算等知识点,这些知识点都是高考热点,会根据价层电子对互斥理论确定原子杂化方式及分子空间构型,难度中等.

练习册系列答案
相关题目
8.在水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、CO32- | D. | K+、NO3-、OH-、SO42- |
9.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 3.55gCl2通入足量水中充分反应,转移电子数为0.05NA | |
| B. | 18gNH4+含有质子数为10NA | |
| C. | 13.8gNO2与足量水反应时,转移电子的数目为0.2NA | |
| D. | 标准状况下,相同体积的SO3、HCl、NO含有的分子数相同 |
13.下列物质的用途中,不正确的是( )
| A. | Na2O作呼吸面具中的供氧剂 | B. | 小苏打做发酵粉 | ||
| C. | 镁合金用于制造汽车、飞机、火箭 | D. | 漂白粉做消毒剂 |
7.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 11.2 L NH3中所含的原子数为2NA | |
| B. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
8.用接触法制5t98%的浓硫酸,在理论上需要FeS270%(杂质不含碳元素)的硫铁矿为( )
| A. | 86t | B. | 8.6t | C. | 4.3t | D. | 43t |
 在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:
在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题: