题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48g的O3含有的氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、常温常压下,11.2L氧气所含的原子数为NA |
| D、2.4g金属镁变为镁离子时失去的电子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量结合臭氧分子式计算氧原子数;
B、依据n=
计算物质的量,结合铵根离子是10电子微粒计算;
C、结合气体摩尔体积概念分析,标准状况气体摩尔体积22.4L/mol;
D、依据n=
计算物质的量,结合镁原子最外层2个电子分析;
| m |
| M |
B、依据n=
| m |
| M |
C、结合气体摩尔体积概念分析,标准状况气体摩尔体积22.4L/mol;
D、依据n=
| m |
| M |
解答:
解:A、依据n=
计算物质的量=
=1mol,结合臭氧分子式计算氧原子数3NA,故A正确;
B、依据n=
计算物质的量=
=0.1mol,结合铵根离子是10电子微粒计算含有的电子数为1NA,故B错误;
C、结合气体摩尔体积概念分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量不是0.5mol,故C错误;
D、依据n=
计算物质的量=
=0.1mol,结合镁原子最外层2个电子分析得到镁变为镁离子时失去的电子数为0.2NA,故D正确;
故选AD.
| m |
| M |
| 48g |
| 48g/mol |
B、依据n=
| m |
| M |
| 1.8g |
| 18g/mol |
C、结合气体摩尔体积概念分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量不是0.5mol,故C错误;
D、依据n=
| m |
| M |
| 2.4g |
| 24g/mol |
故选AD.
点评:本题考查了阿伏伽德罗常数的分析应用主要是气体摩尔体积的条件应用,物质的量计算微粒数的方法,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
O2在放电条件下可发生下列反应:3O2
2O3,若放电后混合气体对H2的相对密度为17.8,则氧气转化为臭氧的物质的量分数为( )
| ||
| A、30% | B、25% |
| C、35% | D、90% |
X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4.则下列判断正确的是( )
| A、非金属性:X<Y<Z |
| B、含氧酸的酸性:H3ZO4>H2YO4>HXO4 |
| C、气态氢化物稳定性:按X、Y、Z顺序增加 |
| D、元素电负性:按X、Y、Z变小 |
下列叙述中正确的是( )
| A、元素周期表中有18个纵行,所以有18个族 |
| B、除第一周期外,其他周期均有18个元素 |
| C、副族元素中没有非金属元素 |
| D、碱金属元素是指ⅠA族的所有元素 |
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+O2(g)=H2O(l)△H=-285.8kJ/mol
CO(g)+O2(g)=CO2(g)△H=-283.0kJ/mol
C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
H2(g)+O2(g)=H2O(l)△H=-285.8kJ/mol
CO(g)+O2(g)=CO2(g)△H=-283.0kJ/mol
C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
| A、H2 (g) |
| B、CO(g) |
| C、C8H18 (l) |
| D、CH4(g) |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、0.5mol/L的MgCl2溶液,含有Cl-个数为 NA |
| B、2.3 g Na+离子中含有的电子数为1 NA |
| C、标准状况下,1摩尔SO3的体积为22.4 L |
| D、标准状况下,11.2 L H2O所含的分子数为0.5 NA |
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32- |
| B、反应最后形成的溶液中的溶质为NaCl |
| C、原溶液中一定含有Na2SO4 |
| D、原溶液中含有CO32-与AlO2- 的物质的量之比为1:2 |
化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A、明矾-Al2 (SO4)3 |
| B、苛性钠-Na2O2 |
| C、小苏打-NaHCO3 |
| D、生石灰-Ca(OH)2 |
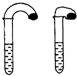 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下: