题目内容
8.下列离子方程式书写正确的是( )| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
分析 A.铁与稀硫酸反应生成的亚铁离子;
B.碳酸钙和醋酸都不能拆开;
C.碳酸钙为难溶物,离子方程式中不能拆开;
D.澄清石灰水中的氢氧化钙需要拆开,盐酸与氢氧化钙反应生成氯化钙和水.
解答 解:A.铁与稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═H2↑+Fe2+,故A错误;
B.醋酸为弱酸,不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故C错误;
D.盐酸与饱和的澄清石灰水反应生成氯化钙和水,反应的离子方程式为:H++OH-═H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
18.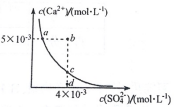 常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
 常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )| A. | b 点可能有沉淀生成 | |
| B. | a 点对应的Ksp 等于c 点对应的Ksp | |
| C. | 在d 点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| D. | CaSO4 溶解在水中,一定有c(Ca2+)=c(SO42-)=3×10-3mol•L-1 |
19.下列说法正确的是( )
| A. | 用石墨棒做电极电解氯化铜溶液,与负极相连的石墨棒上有气泡产生 | |
| B. | 氢氧燃料电池工作时氢气在负极被氧化 | |
| C. | 铅蓄电池充电时,PbSO4仅在负极生成 | |
| D. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层,这种变化属于原电池反应 |
16.下列各离子组可在同一溶液中大量共存,且形成无色溶液的是( )
| A. | Fe2+、H+、NO3-、Cl- | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Mg2+、OH-、SO42- | D. | K+、Na+、OH-、NO3- |
3.生活因化学而精彩,化学因实验而生动,实验因“洗涤”而更加精准,关于沉淀或晶体洗涤的说法错误的是( )
| A. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| D. | 洗涤的操作是向过滤器里加洗涤剂,一般洗涤剂尽量多加,然后让洗涤剂自然流下 |
13.现有失去标签的四瓶无色溶液分别为Na2CO3溶液、稀盐酸、Ba(OH)2溶液、NaHSO4溶液,为确定四瓶溶液分别是什么,将其随意标号为A、B、C、D,分别取少量溶液两两混合,产生的现象如表所示.
已知:NaHSO4属于酸式盐,在水溶液中的电离方程式为:NaHSO4═Na++H++SO42-.
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸
(2)写出下列反应的离子方程式A+B:CO32-+Ba2+=BaCO3↓,A+D:CO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.
| 实验顺序 | 实验内容 | 实验现象 | 实验顺序 | 实验内容 | 实验现象 | |
| ① | A+B | 生成白色沉淀 | ④ | B+C | 无明显变化 | |
| ② | A+C | 放出无色气体 | ⑤ | B+D | 生成白色沉淀 | |
| ③ | A+D | 放出无色气体 | ⑥ | C+D | 无明显变化 |
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸
(2)写出下列反应的离子方程式A+B:CO32-+Ba2+=BaCO3↓,A+D:CO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.
20.设 N A表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g Fe 和足量的氧气完全燃烧失去电子数为 3N A | |
| B. | 1L 浓度为 0.5mol/LFeCl3 溶液加热煮沸后,会生成 0.5molFe(OH)3胶体粒子 | |
| C. | 常温常压下,23 g NO2 和 N2O4 的混合气体一定含有 N A 个氧原子 | |
| D. | 标况下,4.48L 的水中含有 H2O 分子的数目为 0.2N A |
19.“2015•8•12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.已知部分弱酸的电离平衡常数如下表:
(1)根据价键规则,写出H2CO3的结构式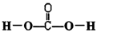 .
.
(2)下列能用于判断氮、碳两种元素非金属性强弱的是abcd(填序号)
a.气态氢化物的稳定性强弱 b.最高价氧化物对应水化物酸性强弱
c.Al2O3+N2+3C=2AlN+3CO d.比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因CN-+H2O?HCN+OH-. 请判断该溶液中:c(CN-) c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.
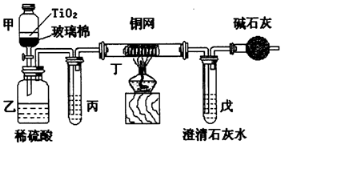
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200ml倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为CN-+ClO-=CNO-+Cl-,乙中反应的离子方程式为2CNO-+3ClO-+2H+=N2↑+2CO2↑+H2O+3Cl-.
②上述实验是通过测定CO2的量来确定CN-的处理效果.若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是HCl、Cl2,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为90%.
(5)装置中碱石灰的作用是防止空气中的CO2进入戊,影响对产物的测定.
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
 .
.(2)下列能用于判断氮、碳两种元素非金属性强弱的是abcd(填序号)
a.气态氢化物的稳定性强弱 b.最高价氧化物对应水化物酸性强弱
c.Al2O3+N2+3C=2AlN+3CO d.比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因CN-+H2O?HCN+OH-. 请判断该溶液中:c(CN-) c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200ml倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为CN-+ClO-=CNO-+Cl-,乙中反应的离子方程式为2CNO-+3ClO-+2H+=N2↑+2CO2↑+H2O+3Cl-.
②上述实验是通过测定CO2的量来确定CN-的处理效果.若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是HCl、Cl2,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为90%.
(5)装置中碱石灰的作用是防止空气中的CO2进入戊,影响对产物的测定.