题目内容
ZnSO4?7H2O 多为无色透明结晶状粉末,应用十分广泛.其制备过程如下如图1:
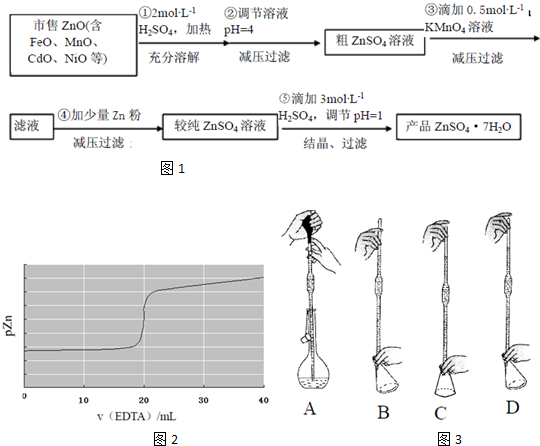
已知:①金属活动性:Zn 大于Cd 和Ni.
②沉淀完全的pH 值范围:Fe(OH)3 2.7~3.7;Zn(OH)2 7~8
根据题意完成下列填空:
(1)步骤②中调节溶液pH=4 适宜加入的试剂是 .(用相应的编号填写)
A.NaOH 溶液 B.ZnO C.Zn3(OH)4CO2?H2O D.氨水
(2)步骤③中加KMnO4的作用是氧化Fe2+和Mn2+,使其以MnO2和Fe(OH)3沉淀的形式除去.请配平:
MnO4-+ Mn2++ H2O= MnO2+ H+
写出氧化Fe2+的离子反应方程式: .
(3)步骤④中加少量Zn粉的目的是 .步骤⑤中调节pH=1 的目的是 (用必要的反应方程式和文字说明).
(4)步骤②③④⑤中均需用抽滤装置,过滤结束后,取出所得沉淀物的方法是 .
(5)用电子天平称取所得晶体0.820g 置于烧杯中,用稀硫酸溶解后,移入250mL 容量瓶,洗涤后定容,用移液管移取25.00mL 置于锥形瓶中,用0.0100mol/L EDTA 滴定,滴定曲线(pZn=-lgc(Zn2+)与V(EDTA))如图3所示.下列有关用移液管移取25.00mL 溶液的正确操作是 .若滴定反应为:Zn2++EDTA=Zn2+-EDTA,则该样品的纯度是 .

已知:①金属活动性:Zn 大于Cd 和Ni.
②沉淀完全的pH 值范围:Fe(OH)3 2.7~3.7;Zn(OH)2 7~8
根据题意完成下列填空:
(1)步骤②中调节溶液pH=4 适宜加入的试剂是
A.NaOH 溶液 B.ZnO C.Zn3(OH)4CO2?H2O D.氨水
(2)步骤③中加KMnO4的作用是氧化Fe2+和Mn2+,使其以MnO2和Fe(OH)3沉淀的形式除去.请配平:
写出氧化Fe2+的离子反应方程式:
(3)步骤④中加少量Zn粉的目的是
(4)步骤②③④⑤中均需用抽滤装置,过滤结束后,取出所得沉淀物的方法是
(5)用电子天平称取所得晶体0.820g 置于烧杯中,用稀硫酸溶解后,移入250mL 容量瓶,洗涤后定容,用移液管移取25.00mL 置于锥形瓶中,用0.0100mol/L EDTA 滴定,滴定曲线(pZn=-lgc(Zn2+)与V(EDTA))如图3所示.下列有关用移液管移取25.00mL 溶液的正确操作是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)氢氧化铁沉淀完全的pH值范围:2.7~3.7,调节溶液pH=4的目的是除去铁离子,除去旧杂质不能引入新杂质,据此解答即可;
(2)依据氧化还原反应中得失电子守恒配平方程式即可;
(3)由于金属活动性:Zn大于Cd和Ni,在步骤④中加少量Zn粉的目的是除去Cd2+和Ni2+离子,由于锌离子在水中存在水解反应,故调节pH=1的目的是抑制锌离子水解;
(4)依据从漏斗上取下固体的方法解答即可,注意手的分工操作与接收容器可以是洁净的滤纸或表面皿;
(5)认真观察图象,找出突变的点,然后依据所给方程式计算即可.
(2)依据氧化还原反应中得失电子守恒配平方程式即可;
(3)由于金属活动性:Zn大于Cd和Ni,在步骤④中加少量Zn粉的目的是除去Cd2+和Ni2+离子,由于锌离子在水中存在水解反应,故调节pH=1的目的是抑制锌离子水解;
(4)依据从漏斗上取下固体的方法解答即可,注意手的分工操作与接收容器可以是洁净的滤纸或表面皿;
(5)认真观察图象,找出突变的点,然后依据所给方程式计算即可.
解答:
解:(1)由于Fe(OH)3沉淀完全的pH值范围是:2.7~3.7,故调节溶液pH=4的目的是除去铁离子,除去旧杂质不能引入新杂质,A中引入钠离子,D中引入铵根,故AD错误,BC正确,故选BC;
(2)KMnO4具有强氧化性,加入它的作用是氧化Fe2+和Mn2+,依据得失电子守恒,离子反应方程式分别为:2MnO4-+3Mn2++2H2O=5MnO2+4H+,MnO4-+3Fe2++7H2O=3Fe(OH)3↓+5H++MnO2,故答案为:2、3、2、5、4;MnO4-+3Fe2++7H2O=3Fe(OH)3↓+5H++MnO2;
(3)金属活动性:Zn大于Cd和Ni,在步骤④中加少量Zn粉的目的是除去Cd2+和Ni2+离子,由于锌离子在水中存在水解反应:Zn2++2H2O?Zn(OH)2+2H+,故调节pH=1的目的是抑制锌离子水解,故答案为:除去Cd2+和Ni2+杂质离子;因为Zn2++2H2O?Zn(OH)2+2H+,调节pH=1,可以使上述平衡向逆反应方向移动,达到抑制Zn2+水解的目的;
(4)过滤结束后,取出所得沉淀物的方法是:将漏斗从抽滤瓶上取下,左手握漏斗管,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的纸片或表面皿上,故答案为:将漏斗从抽滤瓶上取下,左手握漏斗管,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的纸片或表面皿上;
(5)0.820g ZnSO4?7H2O 配制成溶液,取出25mL,依据表格所知:在EDTA的体积为20mL时达到滴定终点,依据Zn2++EDTA=Zn2+-EDTA有:0.0100mol/L×20mL=25mL×c,解c=0.008mol/L,故原溶液中溶质的质量为:0.008mol/L×25mL×
×287g/mol×10-3=0.574g,故含量为:
×100%=70%,故答案为:70%.
(2)KMnO4具有强氧化性,加入它的作用是氧化Fe2+和Mn2+,依据得失电子守恒,离子反应方程式分别为:2MnO4-+3Mn2++2H2O=5MnO2+4H+,MnO4-+3Fe2++7H2O=3Fe(OH)3↓+5H++MnO2,故答案为:2、3、2、5、4;MnO4-+3Fe2++7H2O=3Fe(OH)3↓+5H++MnO2;
(3)金属活动性:Zn大于Cd和Ni,在步骤④中加少量Zn粉的目的是除去Cd2+和Ni2+离子,由于锌离子在水中存在水解反应:Zn2++2H2O?Zn(OH)2+2H+,故调节pH=1的目的是抑制锌离子水解,故答案为:除去Cd2+和Ni2+杂质离子;因为Zn2++2H2O?Zn(OH)2+2H+,调节pH=1,可以使上述平衡向逆反应方向移动,达到抑制Zn2+水解的目的;
(4)过滤结束后,取出所得沉淀物的方法是:将漏斗从抽滤瓶上取下,左手握漏斗管,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的纸片或表面皿上,故答案为:将漏斗从抽滤瓶上取下,左手握漏斗管,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的纸片或表面皿上;
(5)0.820g ZnSO4?7H2O 配制成溶液,取出25mL,依据表格所知:在EDTA的体积为20mL时达到滴定终点,依据Zn2++EDTA=Zn2+-EDTA有:0.0100mol/L×20mL=25mL×c,解c=0.008mol/L,故原溶液中溶质的质量为:0.008mol/L×25mL×
| 250 |
| 25 |
| 0.574g |
| 0.820g |
点评:本题主要考查的是工业生产硫酸锌的无机流程,涉及实验室常见操作、金属活动性顺序、氧化还原反应、离子反应方程式书写、含量计算等,综合性较强,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验现象预测或实验操作或实验原理正确的是( )


| A、实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明 |
| B、实验Ⅱ:可随关随停,随开随启控制氧气的发生 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性Cl2>Br2>I2 |
| D、实验Ⅳ:小试管中NaHCO3分解,B中石灰水变浑浊,说明稳定性Na2CO3>NaHCO3 |
只用试管和胶头滴管就可以对下列各组中的两种溶液进行鉴别的是( )
①AlCl3溶液和NaOH溶液
②Ca(HCO3)2溶液和NaOH溶液
③NaAlO2溶液和盐酸
④Al2(SO4)3溶液和氨水
⑤Na2CO3溶液和稀盐酸.
①AlCl3溶液和NaOH溶液
②Ca(HCO3)2溶液和NaOH溶液
③NaAlO2溶液和盐酸
④Al2(SO4)3溶液和氨水
⑤Na2CO3溶液和稀盐酸.
| A、①③⑤ | B、①②③ |
| C、②③④ | D、③④⑤ |
一些治感冒的药物含有PPA(醇胺)成分,PPA对感冒有比较好的对症疗效,但也有较大的副作用,我国早已禁止使用含有PPA成分的感冒药.从其名称看,其有机成分的分子结构中不含下列中的( )
| A、-OH |
| B、-COOH |
| C、-C6H5 |
| D、-NH2 |
84消毒液主要成分是( )
| A、NaCl |
| B、NaClO (次氯酸钠) |
| C、Ca(ClO)2 (次氯酸钙) |
| D、CaCl2 |
已知25℃下,0.1mol/L某二元酸(H2A)溶液的pH大于1,其酸式盐NaHA溶液的pH<7.取等体积的H2A溶液和NaOH溶液混合后,所得溶液的pH=7,则酸溶液与碱溶液的物质的量浓度之比是( )
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
 某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.