题目内容
下列实验现象预测或实验操作或实验原理正确的是( )


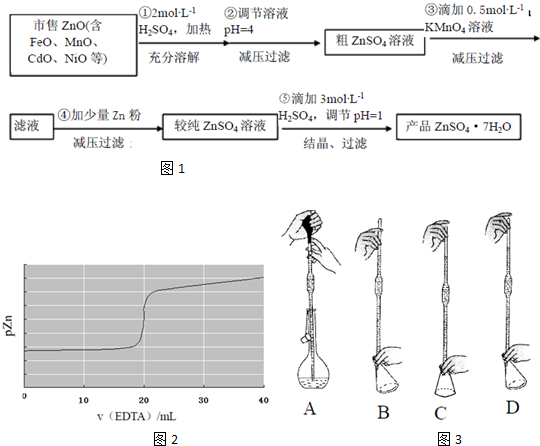
| A、实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明 |
| B、实验Ⅱ:可随关随停,随开随启控制氧气的发生 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性Cl2>Br2>I2 |
| D、实验Ⅳ:小试管中NaHCO3分解,B中石灰水变浑浊,说明稳定性Na2CO3>NaHCO3 |
考点:化学实验方案的评价
专题:
分析:A.苯与水互不相溶;
B.过氧化钠易溶于水;
C.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱;
D.NaHCO3受热易分解.
B.过氧化钠易溶于水;
C.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱;
D.NaHCO3受热易分解.
解答:
解:A.单质溴能与NaOH溶液发生氧化还原反应,所以振荡后静置,上层溶液颜色会逐渐消失,苯不溶于水,溶液分层,故A错误;
B.过氧化钠易溶于水,不能做到随关随停,故B错误;
C.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱,应先将溴中的氯气除去,故C错误;
D.NaHCO3受热易分解生成二氧化碳,碳酸钠受热不分解,二氧化碳能使澄清的石灰水变浑浊,故D正确.
故选D.
B.过氧化钠易溶于水,不能做到随关随停,故B错误;
C.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱,应先将溴中的氯气除去,故C错误;
D.NaHCO3受热易分解生成二氧化碳,碳酸钠受热不分解,二氧化碳能使澄清的石灰水变浑浊,故D正确.
故选D.
点评:本题考查化学实验方案的评价,涉及实验基本操作以及氧化性比较、碳酸钠、碳酸氢钠的性质等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性和合理性,难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
下列离子方程式书写正确的是( )
| A、赤铁矿投入到稀盐酸中:FeO+2H+═Fe2++H2O |
| B、FeCl3溶液中加入氢氧化钠溶液:Fe2++3OH-═Fe(OH)2↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
乘车前都要进行安检,易燃、易爆、剧毒、易腐蚀、强氧化剂等物品严禁上车.下列物品可让乘客带上车的是( )
①浓硫酸 ②氰化钾 ③水银 ④汽油 ⑤黑火药 ⑥白磷 ⑦酒精.
①浓硫酸 ②氰化钾 ③水银 ④汽油 ⑤黑火药 ⑥白磷 ⑦酒精.
| A、①④⑤ |
| B、①②⑥⑦ |
| C、①③④⑤⑦ |
| D、全部都不能带上车 |
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A、Al3+、K+、SO42-、Cl-、AlO2- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是 请按下列要求填空
请按下列要求填空