题目内容
9.下列各组元素都属于短周期金属元素的是( )| A. | H C Zn | B. | Li Na Al | C. | Mg Al Si | D. | Na Cl Fe |
分析 元素周期表中,前3周期元素为短周期元素,原子序数小于18,为主族和0族元素,可以根据原子序数及金属、非金属元素的概念对各选项进行判断.
解答 解:A.H、C为短周期元素,而Zn为第四周期元素,故A错误;
B.Li、Na、Al的原子序数都小于18,都属于短周期金属元素,故B正确;
C.Mg、Al的原子序数小于18,为短周期金属元素,而Si为短周期的非金属元素,故C错误;
D.Cl元素为非金属元素,Fe为第四周期元素,故D错误;
故选B.
点评 本题考查了元素周期表结构及其应用,题目难度不大,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期表的关系,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
19.某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:
(1)写出铝片与盐酸、硫酸反应的离子方程式2Al+6H+=2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小.其原因是反应1~15min内,反应放出热量,温度升高,使化学反应速率加快;15~20min内,由于溶液中H+浓度降低,所以导致反应速率减小
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,SO42-对该反应不影响.
假设二:SO42对金属铝与H+反应没有影响.
假设三:SO42对金属铝与H+反应有抑制作用.
假设四:带低电荷的阴离子对金属铝与H+反应有促进作用.
请你以“假设一”为实验课题,设计实验方案探究,要求出主要实验步骤将NaCl颗粒加入Al片与稀盐酸反应液中,看反应速率有无变化及变化情况,来判断Cl-是否对反应起作用.若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响.将K2SO4颗粒加入Al片与稀H2SO4反应液中,看反应速率有无变化及变化情况,来判断SO42-是否对反应起作用.若速率减小,说明SO42对该反应有抑制作用;若速率不变,说明SO42对该反应的速率不影响.
| 1min | 2min | 5min | 15min | 20min | |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 打量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol•L-1H2SO4 | 均无明显现象(只有少量气泡) | ||||
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小.其原因是反应1~15min内,反应放出热量,温度升高,使化学反应速率加快;15~20min内,由于溶液中H+浓度降低,所以导致反应速率减小
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,SO42-对该反应不影响.
假设二:SO42对金属铝与H+反应没有影响.
假设三:SO42对金属铝与H+反应有抑制作用.
假设四:带低电荷的阴离子对金属铝与H+反应有促进作用.
请你以“假设一”为实验课题,设计实验方案探究,要求出主要实验步骤将NaCl颗粒加入Al片与稀盐酸反应液中,看反应速率有无变化及变化情况,来判断Cl-是否对反应起作用.若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响.将K2SO4颗粒加入Al片与稀H2SO4反应液中,看反应速率有无变化及变化情况,来判断SO42-是否对反应起作用.若速率减小,说明SO42对该反应有抑制作用;若速率不变,说明SO42对该反应的速率不影响.
4.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ•mol-1)
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1.
(2)写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式2H2(g)+S2(g)═2H2S(g)△H=-229kJ•mol-1.
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1.
(2)写出H2(g)与S2(g)反应生成H2S(g)的热化学方程式2H2(g)+S2(g)═2H2S(g)△H=-229kJ•mol-1.
14.硬质玻璃管进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.
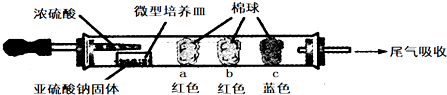
请填写表中的空白:

请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: 2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 结论:该气体具有还原 性 |
1.分子式为C7H6O2的芳香族化合物的数目有( )
| A. | 2种 | B. | 3种 | C. | 4 | D. | 5种 |
18.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
下列说法正确的是( )
| A. | 1molCO(g)完全燃烧生成CO2(g)放出热量283J | |
| B. | 1molCO(g)完全燃烧比1molC(s)完全燃烧放出的热量多 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2 (g)△H<-452kJ/mol | |
| D. | 当Na2O2(s)与CO2(g)反应生成Na2CO3(s)和O2 (g)放出452kJ热量时,转移的电子数为2mol |
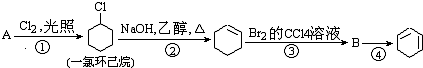
 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.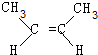 、
、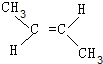 .
.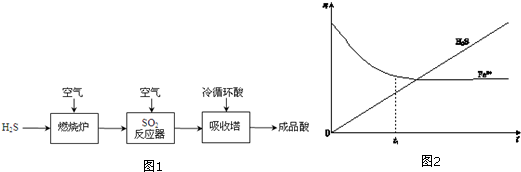
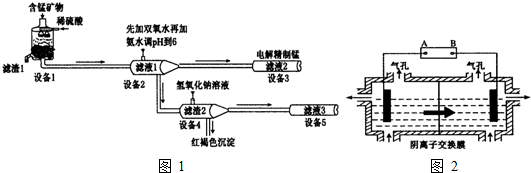
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.