题目内容
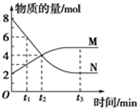 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:
(1)该反应的化学方程式为
(2)若t2=2min,N的平均反应速率为
(3)在t3时刻v正
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法
专题:化学反应速率专题
分析:(1)由图可知,N减少,M增加,利用量的变化来分析判断;
(2)根据反应速率v=
计算;
(3)t3时刻M、N的物质的量均不再变化,反应达到平衡状态.
(2)根据反应速率v=
| △c |
| △t |
(3)t3时刻M、N的物质的量均不再变化,反应达到平衡状态.
解答:
解:(1)由图可知,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,N为反应物,M为生成物,变化量之比为2:1,即化学计量数之比为2:1,反应为2N?M;
故答案为:2N?M;
(2)t2=2min,N的平均反应速率v=
=
=1mol?L-1?min-1;
故答案为;1mol?L-1?min-1;
(3)t3时刻M、N的物质的量均不再变化,反应达到平衡状态,故v正=v逆.
故答案为:=.
故答案为:2N?M;
(2)t2=2min,N的平均反应速率v=
| △c |
| △t |
| ||
| 2min |
故答案为;1mol?L-1?min-1;
(3)t3时刻M、N的物质的量均不再变化,反应达到平衡状态,故v正=v逆.
故答案为:=.
点评:本题考查了根据图象计算化学反应速率、判断化学平衡状态的问题,难度不大,注意把握图象的分析.

练习册系列答案
相关题目
下列化合物中既存在离子键,又存在极性键是( )
| A、H2O |
| B、NaCl |
| C、NaOH |
| D、Na2O2 |
下列离子方程式书写正确的是( )
| A、铁片放入稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
| B、大理石放入稀硝酸中:CO32-+2 H+=CO2↑+H2O |
| C、铁片插入硫酸铜溶液中:Fe+Cu2+=Cu+Fe2+ |
| D、碳酸钠溶液与盐酸反应,有气泡逸出:Na2CO3+2H+=2Na++CO2↑+H2O |
下列事实能说明醋酸是弱酸的是( )
①醋酸钠溶液中CH3COO-与CH3COOH共存
②0.1mol/L的醋酸钠溶液的pH值约为9
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④0.1mol/L的醋酸的pH值约为4.8
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多.
①醋酸钠溶液中CH3COO-与CH3COOH共存
②0.1mol/L的醋酸钠溶液的pH值约为9
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④0.1mol/L的醋酸的pH值约为4.8
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多.
| A、①②④⑤ | B、②④ |
| C、②③④ | D、②③ |
在氢气与氧气燃烧的过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ.下列关系式中,正确的是( )
| A、Q1+Q2<Q3 |
| B、Q1+Q2>2Q3 |
| C、2Q1+Q2>2Q3 |
| D、2Q1+Q2<2Q3 |
 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )| A、虚线相连的元素处于同一族 |
| B、离0点越远的元素原子半径越大 |
| C、.B、C最高价氧化物的水化物可相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
 实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:
实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器: