题目内容
下列化合物中既存在离子键,又存在极性键是( )
| A、H2O |
| B、NaCl |
| C、NaOH |
| D、Na2O2 |
考点:离子键的形成,极性键和非极性键
专题:化学键与晶体结构
分析:一般来说,活泼金属与活泼非金属元素之间形成的化学键为离子键,相同非金属原子之间形成的共价键为非极性共价键,不同原子之间形成的为极性共价键,以此解答该题.
解答:
解:A.水分子中含有极性键O-H,不含有离子键,故A错误;
B.NaCl只含有离子键,不含共价键,故B错误;
C.NaOH为离子化合物,含有离子键和极性共价键,不含非极性共价键,故C正确;
D.过氧化钠为离子化合物,含有离子键,且含有O-O非极性键,故D错误.
故选C.
B.NaCl只含有离子键,不含共价键,故B错误;
C.NaOH为离子化合物,含有离子键和极性共价键,不含非极性共价键,故C正确;
D.过氧化钠为离子化合物,含有离子键,且含有O-O非极性键,故D错误.
故选C.
点评:本题考查化学键的考查,为高频考点,注意把握化学键类型的判断角度以及相关物质的性质,把握极性键和非极性键的区别,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学反应过程中,△H小于零的是( )
| A、碳跟水蒸气反应制备水煤气 |
| B、氯化铵与熟石灰共热制备氨气 |
| C、高温煅烧石灰石 |
| D、锌跟稀硫酸反应制备氢气 |
 如图是某学校实验室从化学试剂商店买的98%硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买的98%硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A、该硫酸的物质的量浓度为1.84mol/L |
| B、1mol Zn与足量的该硫酸反应产生2gH2 |
| C、配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
设NA为阿伏伽德罗常数,下列说法正确的是( )
| A、高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B、室温下PH=13的NaOH溶液中,由水电离的OH-的数目为0.1NA |
| C、氢氧燃料电池正极消耗22.4L(标况)气体时,电路中通过的电子数目是2NA |
| D、18gH2O含有10NA个质子 |
下列说法正确的是( )
| A、可用丁达尔现象区分葡萄糖溶液和淀粉胶体 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、0.lmolNH4+离子中所含的电子数为1.1 NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |
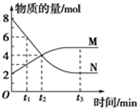 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.