题目内容
下列事实能说明醋酸是弱酸的是( )
①醋酸钠溶液中CH3COO-与CH3COOH共存
②0.1mol/L的醋酸钠溶液的pH值约为9
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④0.1mol/L的醋酸的pH值约为4.8
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多.
①醋酸钠溶液中CH3COO-与CH3COOH共存
②0.1mol/L的醋酸钠溶液的pH值约为9
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④0.1mol/L的醋酸的pH值约为4.8
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多.
| A、①②④⑤ | B、②④ |
| C、②③④ | D、②③ |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:证明醋酸是弱电解质的方法有:1.根据醋酸的电离程度,2.根据醋酸的强碱盐溶液的酸碱性判断.
解答:
解:①醋酸钠溶液中CH3COO-与CH3COOH共存,说明醋酸根离子水解生成弱电解质醋酸,故正确;
②0.1mol/L的醋酸钠溶液的pH值约为9,说明醋酸钠是强碱弱酸盐,故正确;
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸是二元强酸,所以硫酸溶液消耗的氢氧化钠多,但不能说明醋酸是弱电解质,故错误;
④0.1mol/L的醋酸的pH值约为4.8,说明醋酸部分电离,故正确;
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多,说明醋酸部分电离,溶液中存在大量的醋酸分子,故正确;
故选A.
②0.1mol/L的醋酸钠溶液的pH值约为9,说明醋酸钠是强碱弱酸盐,故正确;
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸是二元强酸,所以硫酸溶液消耗的氢氧化钠多,但不能说明醋酸是弱电解质,故错误;
④0.1mol/L的醋酸的pH值约为4.8,说明醋酸部分电离,故正确;
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多,说明醋酸部分电离,溶液中存在大量的醋酸分子,故正确;
故选A.
点评:本题考查了弱电解质的判断,电解质的强弱与其电离程度有关,只有部分电离的电解质是弱电解质.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
下列化学反应过程中,△H小于零的是( )
| A、碳跟水蒸气反应制备水煤气 |
| B、氯化铵与熟石灰共热制备氨气 |
| C、高温煅烧石灰石 |
| D、锌跟稀硫酸反应制备氢气 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、0.lmolNH4+离子中所含的电子数为1.1 NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |
只含有一种元素的物质( )
| A、一定是一种单质 |
| B、可能是单质也可能是化合物 |
| C、一定是纯净物 |
| D、可能是纯净物也可能是混合物 |
在二氧化碳的饱和溶液中,C(H+)和C(CO32-)的比值( )
| A、等于1 | B、等于2 |
| C、大于2 | D、1-2之间 |
下列说法正确的是( )
| A、在“铜锌原电池”中,盐桥中的阴离子移向铜电极 |
| B、在“铜锌原电池”中,当导线中有0.2mol电子通过时,锌极质量增加6.5g |
| C、当马口铁(镀锡)和白铁皮(镀锌)的金属镀层损坏后,白铁皮更易被腐蚀 |
| D、钢铁是铁和碳的合舍,它可以与表面的一层电解质溶液形成很多微小的原电池 |
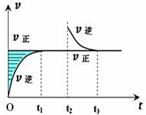 某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )
某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )| A、M和N在该条件下至少有一种是气态 |
| B、t2时刻后该可逆反应向逆反应方向进行,P的浓度一定减小 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(Q),则t1~t2时间段与t3时刻后的Q浓度不相等 |
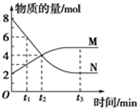 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.