题目内容
 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )| A、虚线相连的元素处于同一族 |
| B、离0点越远的元素原子半径越大 |
| C、.B、C最高价氧化物的水化物可相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:0点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,O、B连线的三元素为第ⅠA族,A为O元素,B为Na元素,C为Si元素,D为S元素,根据元素的种类可知虚线相连的元素处于同一族,结合对应元素的性质解答该题.
解答:
解:0点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,O、B连线的三元素为第ⅠA族,A为O元素,B为Na元素,C为Si元素,D为S元素,
A、由原子序数可知,虚线相连的元素处于同一族,故A正确;
B、离O点越远的元素原子的核电荷数增大,若电子层相同,半径越小,故B错误;
C、B为Na元素,C为Al元素,最高价氧化物的水化物分别为NaOH和Al(OH)3,Al(OH)3具有两性,可与强碱反应,故C正确;
D、钠与氧元素可以形成过氧化钠,过氧根离子中氧原子之间为非极性键,故D错误.
故选:AC.
A、由原子序数可知,虚线相连的元素处于同一族,故A正确;
B、离O点越远的元素原子的核电荷数增大,若电子层相同,半径越小,故B错误;
C、B为Na元素,C为Al元素,最高价氧化物的水化物分别为NaOH和Al(OH)3,Al(OH)3具有两性,可与强碱反应,故C正确;
D、钠与氧元素可以形成过氧化钠,过氧根离子中氧原子之间为非极性键,故D错误.
故选:AC.
点评:本题考查元素周期表、元素周期律、化学键等,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大,看懂图象推断元素是解题的关键,注意对元素周期表的整体把握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、0.lmolNH4+离子中所含的电子数为1.1 NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |
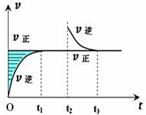 某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )
某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )| A、M和N在该条件下至少有一种是气态 |
| B、t2时刻后该可逆反应向逆反应方向进行,P的浓度一定减小 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(Q),则t1~t2时间段与t3时刻后的Q浓度不相等 |
有4种燃料电池下面是工作原理示意图,其中正极反应的产物为水的是( )
A、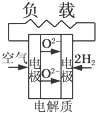 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、 质子交换膜燃料电池 |
D、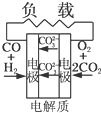 熔融盐燃料电池 |
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A、常温下,1mol丙烯中含碳原子数为3NA |
| B、常温下,pH=13的NaOH溶液中含OH-数为NA |
| C、标准状况下,22.4LCHCl3中含C-H键数为NA |
| D、23gNa与足量氧气反应时转移的电子数为2NA |
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知( )
| A、化学反应速率变化时,化学平衡一定发生移动 |
| B、化学平衡发生移动时,化学反应速率一定变化 |
| C、正反应进行的程度大,正反应速率一定大 |
| D、改变压强,化学反应速率一定改变,平衡一定移动 |
关于如图实验的说法正确的是( )

| A、实验Ⅰ:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成.该现象是由于甲烷与氯气在光照条件下发生了置换反应 |
| B、实验Ⅱ:可以比较KMnO4、Cl2和S氧化性的相对强弱 |
| C、实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定可产生丁达尔效应 |
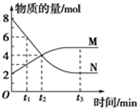 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.