题目内容
4.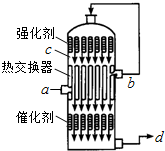 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )| A. | a、b两处的混合气体成分含量相同,温度不同 | |
| B. | c、d两处的混合气体成分含量相同,温度不同 | |
| C. | 热交换器的作用是预热待反应的气体,冷却反应后的气体 | |
| D. | c处气体经热交换后再次催化氧化的目的是提高SO2的转化率 |
分析 A.从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体;
B.在c处出来的气体SO2、O2在催化剂表面发生反应产生的含有SO3及未反应的SO2、O2等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3变为液态;
C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件;
D.使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率.
解答 解:A.根据装置图可知,从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体,成分与a处相同,故A正确;
B.在c处出来的气体SO2、O2在催化剂表面发生反应产生的含有SO3及未反应的SO2、O2等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3变为液态,故二者含有的气体的成分不相同,故B错误;
C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件,故C正确;
D.处气体经过热交换器后再次被催化氧化,目的就是使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率,故D正确.
故选:B.
点评 本题是对化学与技术的考查,涉及工业制硫酸中SO2催化氧化的设备及工作原理,注意对基础知识的理解掌握.

练习册系列答案
相关题目
14.茶叶中铁元素的检测可经过以下A、B、C、D四个步骤完成,各步骤中选用的实验仪器不会全部都用上的是( )
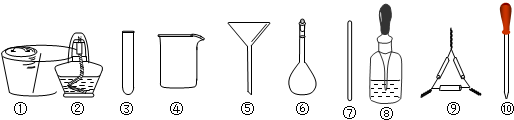

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③和⑧ |
12.现有5.2g Fe和Cu的混合物,向其中加入足量浓硝酸,完全反应后,收集到0.2mol NO2和0.03mol N2O4气体,再向所得溶液中加入1mol/L NaOH溶液得到mg沉淀,下列有关说法正确的是( )
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
19.烷烃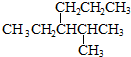 的命名正确的是( )
的命名正确的是( )
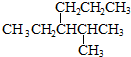 的命名正确的是( )
的命名正确的是( )| A. | 4-甲基-3-丙基戊烷 | B. | 3-异丙基己烷 | ||
| C. | 2-甲基-3-丙基戊烷 | D. | 2-甲基-3-乙基己烷 |
9.随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
a、b、c、d与m、n、x、y之间的关系式为$\frac{c{d}^{2}}{a{b}^{4}}=\frac{x{y}^{2}}{m{n}^{4}}$.
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1mol/L Na2CO3溶液的pH大于0.1mol/L Na2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是ac.(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]d.[H2CO3]>[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变.
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1mol/L Na2CO3溶液的pH大于0.1mol/L Na2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是ac.(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]d.[H2CO3]>[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变.
16.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式等化学用语填空回答以下问题:
(1)在③~⑦中元素,原子半径最大的是Na,⑤其离子的结构示意图为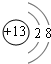 ,非金属性最强的是F.
,非金属性最强的是F.
(2)①~⑩中元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;氢化物最稳定的是HF.
(3)按要求写出下列两种物质的电子式:⑥的氢化物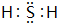 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸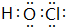 ;
;
(4)在⑦与⑩对应的两种单质中,化学性质较活泼的是Cl2,可用什么化学反应证明明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ,非金属性最强的是F.
,非金属性最强的是F.(2)①~⑩中元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;氢化物最稳定的是HF.
(3)按要求写出下列两种物质的电子式:⑥的氢化物
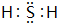 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸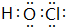 ;
;(4)在⑦与⑩对应的两种单质中,化学性质较活泼的是Cl2,可用什么化学反应证明明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
17.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙与稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| D. | 氯化铁溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+ |
 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.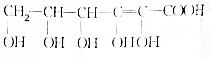 .
.