题目内容
据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇(CH3OH)和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢或锂电池的十倍,可连续使用一个月才充一次电.据此请回答以下问题:
(1)甲醇是 极,电极反应是
(2)电池反应的离子方程式是
(3)用该甲醇电池电解100ml 0.4mol/L的CuCl2溶液,当电池消耗0.3克甲醇时,电解池的阴极析出 克 (物质的化学式),若要恢复CuCl2溶液至原状,需加入 克 (填物质的化学式)
(1)甲醇是
(2)电池反应的离子方程式是
(3)用该甲醇电池电解100ml 0.4mol/L的CuCl2溶液,当电池消耗0.3克甲醇时,电解池的阴极析出
考点:化学电源新型电池
专题:电化学专题
分析:(1)燃料电池中,负极时燃料发生失电子的氧化反应;
(2)燃料电池的总反应是燃料燃烧的方程式,根据电解质环境书写即可;
(3)根据电极反应结合电子守恒知识进行计算,溶液电解后复原的原则:出什么加什么.
(2)燃料电池的总反应是燃料燃烧的方程式,根据电解质环境书写即可;
(3)根据电极反应结合电子守恒知识进行计算,溶液电解后复原的原则:出什么加什么.
解答:
解:(1)甲醇(CH3OH)和氧气以及强碱作电解质溶液的新型手机电池中,甲醇做负极,发生失电子的氧化反应,即CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:负;CH3OH-6e-+8OH-=CO32-+6H2O;
(2)料电池的总反应是燃料燃烧的方程式,在碱性环境下,电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
(3)电解100ml 0.4mol/L的CuCl2溶液,阴极上发生的反应为:Cu2++2e-=Cu,当电池消耗0.3克即0.009375mol甲醇时,转移电子是0.05625mol,此时析出金属铜的质量是0.05625mol×0.5×64g/mol=1.8g,根据铜元素守恒,若要恢复CuCl2溶液至原状,需加入0.05625mol×135g/mol≈7.59g,
故答案为:1.8;Cu;7.59;CuCl2.
(2)料电池的总反应是燃料燃烧的方程式,在碱性环境下,电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
(3)电解100ml 0.4mol/L的CuCl2溶液,阴极上发生的反应为:Cu2++2e-=Cu,当电池消耗0.3克即0.009375mol甲醇时,转移电子是0.05625mol,此时析出金属铜的质量是0.05625mol×0.5×64g/mol=1.8g,根据铜元素守恒,若要恢复CuCl2溶液至原状,需加入0.05625mol×135g/mol≈7.59g,
故答案为:1.8;Cu;7.59;CuCl2.
点评:本题考查学生燃料电池的工作原理以及电子守恒的计算等知识,注意电解质电解后复原的方法:出什么加什么.

练习册系列答案
相关题目
下列离子方程式表达正确的是( )
| A、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
| B、将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| C、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液Ca2++HCO3-+OH-=CaCO3↓++H2O |
能使铁和铝发生钝化反应的溶液是( )
| A、浓盐酸 | B、浓硝酸 |
| C、稀硝酸 | D、浓氢氧化钠溶液 |
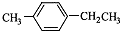 )是一种重要的有机原料,用该物质可合成其他物质.
)是一种重要的有机原料,用该物质可合成其他物质.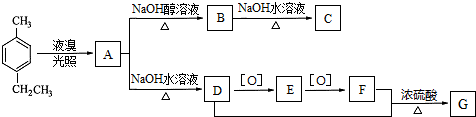
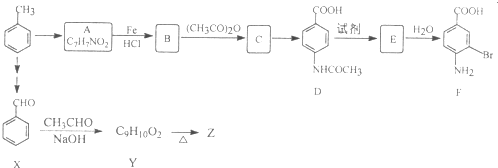
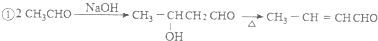
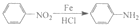 苯胺中氨基易被氧化.
苯胺中氨基易被氧化.