题目内容
16.现有标准状况下的CH4气体4.48L.该气体的物质的量为0.2molmol;该气体的质量为3.2g;该气体拥有的H原子数为0.8NA;与该气体含有相同H原子数的NH3的物质的量为0.267mol.分析 根据n=$\frac{V}{{V}_{m}}$计算4.48LCH4气体的物质的量,m=nM,1molCH4中含有4NA氢原子,结合3CH4~~4NH3,求NH3的物质的量.
解答 解:标况下,4.48LCH4气体的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,m=nM=0.2mol×16g/mol=3.2g,1molCH4中含有4NA氢原子,所以H原子数为4NA×0.2=0.8NA,
3CH4~~4NH3,
3 4
0.2mol n(NH3)
所以n(NH3)=$\frac{0.2×4}{3}$=0.267mol,
故答案为:0.2;3.2;0.267.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算.

练习册系列答案
相关题目
6.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1 L 1mol/L NaHCO3溶液中自由移动的离子总数为3NA | |
| B. | 常温常压下,1.06g Na2CO3含有Na+数目为0.02NA | |
| C. | 1 mol Na2O2与CO2反应电子转移为2 NA | |
| D. | 40g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L |
7.在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
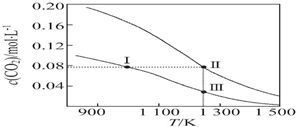

| A. | 反应CO2(g)+C(s)═2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
11.下列关于乙酸的说法不正确的是( )
| A. | 可以除去热水瓶内胆水垢 | B. | 具有挥发性 | ||
| C. | 能与乙醇反应生成有香味的酯 | D. | 能发生加聚反应 |
8.将盛有amolNO2和bmolNO混合气体的试管倒立于水槽中,再通人bmolO2充分反应后试管里剩余气体的成分及物质的量决定于a与b的关系,请填写表格:
| a与b的关系 | 剩余气体的成分 | 剩余气体物质的量 |
| 若a=b | ||
| 若a>b | ||
| 若a<b |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题: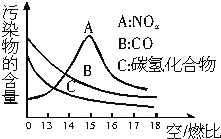 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.