题目内容
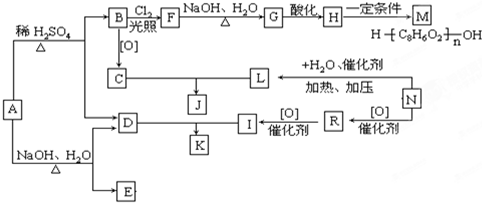
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题:(1)仪器A的名称为
(2)写出硫酸氢铵与过量氢氧化钠溶液反应的离子方程式
(3)指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是
考点:实验装置综合
专题:
分析:(1)结合装置图中仪器图形和作用分析仪器名称,碱石灰用于干燥氨气,氨气极易溶于水,容易发生倒吸现象;
(2)硫酸氢铵与过量氢氧化钠溶液反应,硫酸氢铵溶液中电离生成铵根离子、氢离子和是根离子,其中铵根离子和氢离子与过量氢氧根离子反应生成氨气和水;
(3)反应生成的氨气不能够被稀硫酸完全吸收;
(2)硫酸氢铵与过量氢氧化钠溶液反应,硫酸氢铵溶液中电离生成铵根离子、氢离子和是根离子,其中铵根离子和氢离子与过量氢氧根离子反应生成氨气和水;
(3)反应生成的氨气不能够被稀硫酸完全吸收;
解答:
解:(1)生成的氨气中含有水分,用碱石灰吸收氨气中的水分,氨气极易溶于水,容易发生倒吸,所以广口瓶内四氯化碳用于防止倒吸;
故答案为:吸收氨气中的水蒸气;防止倒吸;
(2)硫酸氢铵与过量氢氧化钠溶液反应,硫酸氢铵溶液中电离生成铵根离子、氢离子和是根离子,其中铵根离子和氢离子与过量氢氧根离子反应生成氨气和水,反应的离子方程式为:NH4++H++2OH-═NH3↑+2H2O;
故答案为:NH4++H++2OH-═NH3↑+2H2O;
(3)用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,由于装置内的氨气不能完全被稀硫酸吸收,测得的样品含氮量仍将偏低,
故答案为:残留在反应装置中的氨气未被稀硫酸吸收;
故答案为:吸收氨气中的水蒸气;防止倒吸;
(2)硫酸氢铵与过量氢氧化钠溶液反应,硫酸氢铵溶液中电离生成铵根离子、氢离子和是根离子,其中铵根离子和氢离子与过量氢氧根离子反应生成氨气和水,反应的离子方程式为:NH4++H++2OH-═NH3↑+2H2O;
故答案为:NH4++H++2OH-═NH3↑+2H2O;
(3)用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,由于装置内的氨气不能完全被稀硫酸吸收,测得的样品含氮量仍将偏低,
故答案为:残留在反应装置中的氨气未被稀硫酸吸收;
点评:本题考查了测定氮肥硫酸铵中氮元素的含量,需要合理分析、离子方程式书写,本题充分考查了所学的分析、理解和综合计算能力,本题难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有如下5种无色溶液:NaAlO2、KOH、NaCl、MgCl2 稀氨水,若要将其一一鉴别开,至少需要用多少种试剂?( )
| A、不用试剂 | B、1种 |
| C、2种 | D、3种 |
下列说法错误的是( )
| A、Na2SO3溶液与BaCl2溶液混合有白色沉淀生成,加稀HNO3沉淀不消失 |
| B、将SO2气体通入足 量Ba(OH)2溶液中有白色沉淀生成,加足 量HCl后沉淀消失 |
| C、将SO2气体通入BaCl2溶液中有白色沉淀生成,加稀HCl后沉淀消失 |
| D、将SO2气体通入氯水中无沉淀生成,加入BaCl2溶液有白色沉淀生成 |
将pH=11NaOH溶液和pH=3的甲酸溶液混合后,对所得溶液呈中性,下列判断一定正确的是( )
| A、c(HCOO-)<c(Na+) |
| B、c(HCOO-)>c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、c(Na+)=c(HCOO-)+c(HCOOH) |