题目内容
10.向50mL 1mol/L AlCl3溶液中加入1.5mol/L NaOH溶液amL,充分反应后,生成白色沉淀1.56g,则a的数值可能是( )| A. | 40和120 | B. | 65和90 | C. | 40和90 | D. | 90和120 |
分析 n(AlCl3)=1mol/L×0.05L=0.05mol,沉淀为氢氧化铝,氢氧化铝的物质的量是0.02mol<0.05mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:n(AlCl3)=1mol/L×0.05L=0.05mol,沉淀为氢氧化铝,氢氧化铝的物质的量是0.02mol<0.05mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
一:氯化铝沉淀不完全时,根据Al3++3OH-═Al(OH)3↓知,n(NaOH)=3n[Al(OH)3]=3×0.02mol=0.06mol,则a=$\frac{0.6mol}{1.5mol/L}$=40mL;
二:生成的沉淀部分溶解,根据Al原子守恒知,溶解n[Al(OH)3]=0.05mol-0.02mol=0.03mol,
根据Al3++3OH-═Al(OH)3↓知,铝离子完全溶解消耗n(NaOH)=3n(Al3+)=3×0.05mol=0.15mol;
根据Al(OH)3 +OH-═AlO2-+2H2O知,溶解0.03mol氢氧化铝消耗n(NaOH)=n[Al(OH)3]=0.03mol,所以总共消耗n(NaOH)=(0.05+0.03)mol=0.18mol,则a=$\frac{0.18mol}{1.5mol/L}$=120mL,
故选A.
点评 本题考查化学方程式有关计算,为高频考点,题目难度中等,侧重考查学生分析计算能力,注意要分两种情况计算,很多学生往往漏掉氢氧化铝溶解而导致错误,为易错题.

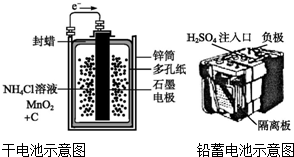
| A. | 上述电池分别属于一次电池、二次电池 | |
| B. | 干电池在长时间使用后,锌筒被破坏 | |
| C. | 铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g | |
| D. | 铅蓄电池负极材料为Pb |
| A. | 其钠盐的化学式为Na2X | B. | X是金属元素 | ||
| C. | 其最高价氧化物的水化物为强酸 | D. | 其最高价氧化物为XO3 |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③⑥⑦.
(3)彼此互为同系物的是(填序号):④⑤.
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:
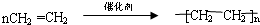 .
.(5)甲苯的一氯取代产物有4种.
| A. | X2YZ4 | B. | XY2Z3 | C. | X3YZ4 | D. | XYZ3 |
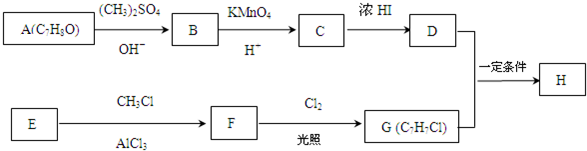
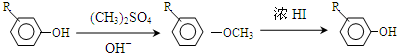
 .
.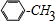 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$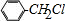 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.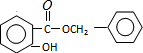 .
. (或
(或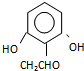 .
.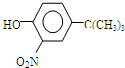
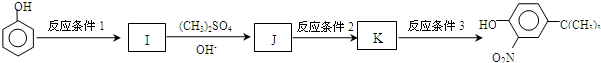
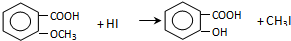
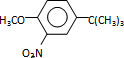 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI. 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: