题目内容
18.如图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑.下列说法错误的是( )
| A. | a、b不可能是同种材料的电极 | |
| B. | X为电流计,c为稀盐酸,该装置为原电池 | |
| C. | X为直流电源,c为稀硫酸,该装置为电解池 | |
| D. | X为电流计,c为稀硫酸,a可能为铜电极,b可能为锌电极 |
分析 根据Zn+2H+═Zn2++H2↑知,锌失电子发生氧化反应,氢离子得电子发生还原反应,该装置可能是原电池也可能是电解池,锌发生的反应可能是原电池负极也可能是电解池阳极上发生的反应,则氢离子发生的反应可能是原电池正极也可能是电解池阳极上发生的反应,如果是原电池,则锌作负极,比锌不活泼的金属或导电的非金属作正极,电解质溶液为酸溶液,如果是电解池,则阳极是锌,电解质溶液是酸或活动性顺序在氢之前的金属盐溶液,据此分析解答.
解答 解:A.如果该装置是电解池,如锌作阴、阳极,电解质溶液是酸,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,所以两个电极可以相同,故A错误;
C.X为直流电源,c为稀硫酸,锌作阳极,电解时,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,故C正确;
B、该装置是原电池,电解质溶液为稀盐酸,锌作负极,正极上氢离子得电子,发生的反应符合离子方程式,故B正确;
D、该装置可看作是铜-锌原电池,电解质溶液是稀硫酸,负极上锌失电子,正极氢离子得电子,符合离子方程式,故D正确.
故选A.
点评 本题考查了原电池和电解池原理,同时考查学生的发散思维能力,明确正、负极和阴、阳极上发生反应的类型是解本题的关键,难度不大.

练习册系列答案
相关题目
8.化学与人类生产、生活密切相关.下列说法正确的是( )
| A. | 减少CO2的排放,可以减少酸雨的产生 | |
| B. | 减少SO2的排放,可以从根本上消除雾霾 | |
| C. | 用电镀厂的废水直接灌溉农田,可提高水的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
9.已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应.用溴水作试剂不可以将下列各选项中的溶液鉴别出来的是( )
| A. | 水、四氯化碳、苯 | B. | AgNO3、NaOH、KI | C. | NaCl、NaBr、NaI | D. | 汽油、酒精、NaOH |
6.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式 .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式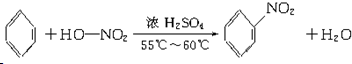 .
.
(4)化合物C的含氧官能团是-OH(写结构),C与E反应能生成相对分子质量为100的酯,该反应类型为酯化反应;其化学方程式为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$CH2=CHCOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+H2O.
| A | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C ③比例模型为:  |
| B | ①由C、H两种元素组成; ②球棍模型为:  |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为:  |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式
 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式
 .
.(4)化合物C的含氧官能团是-OH(写结构),C与E反应能生成相对分子质量为100的酯,该反应类型为酯化反应;其化学方程式为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$CH2=CHCOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+H2O.
13.化学与生活息息相关相关.下列说法正确的是( )
| A. | 工业污水可以直接用于灌溉农田 | |
| B. | 爆竹燃烧时,其中的硫磺燃烧生成三氧化硫 | |
| C. | 碳酸氢钠、氢氧化铝都可作为治疗胃酸过多的药物 | |
| D. | 食品袋中装有生石灰的透气小袋是用于防止食品氧化变质 |
3.下列物质的分类合理的是( )
| A. | 酸:HNO3、H2SO4、NaHSO4、HCl | B. | 碱性氧化物:CuO、Na2O、CaO、MgO | ||
| C. | 胶体:牛奶、豆浆、碘酒、氢氧化铝 | D. | 酸性氧化物:CO2、NO、SiO2、SO3 |
10.有关化学与生产、生活相关的叙述正确的是( )
| A. | 碘酒能消毒是利用碘的还原性 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 14C可用于文物的年代鉴定,14C与12C互为同素异形体 | |
| D. | 某溶液中加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
7.下列属于碱性化合物的是( )
| A. | SiO2 | B. | Na2O | C. | Na2O2 | D. | NaOH |
9.某化学兴趣小组利用如图所示装置对SO2的性质进行实验研究.

请回答下列问题:
(1)装置B的作用是防止倒吸.
(2)装置C的目的是检验SO2还原性.装置D中NaOH全部转化为NaHSO3的标志是溶液红色退去.
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成表.
(已知酸性:H2SO4>H2CO3>HClO)
(4)该小组同学认为,SO2通入含有BaCl2的双氧水中会出现白色沉淀,该反应的离子方程式为SO2+Ba2++H2O2=BaSO4+2H+.

请回答下列问题:
(1)装置B的作用是防止倒吸.
(2)装置C的目的是检验SO2还原性.装置D中NaOH全部转化为NaHSO3的标志是溶液红色退去.
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成表.
(已知酸性:H2SO4>H2CO3>HClO)
| 实验序号 | 实验操作 | 现象 | 可能的情况 |
| ① | 滴加少量淀粉-KI溶液,振荡 | III | |
| ② | 滴加少量溴水,振荡 | II | |
| ③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |