题目内容
2. 有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤:
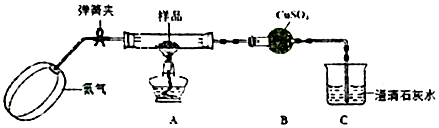
有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤:(1)称取 A 物质 18.0g,升温使其汽化,测其密度是相同条件下 H2的 45 倍,
(2)A 的核磁共振氢谱如图:
(3)另取 A 18.0g 与足量的 NaHCO3粉末反应,生成 0.2molCO2,若与足量钠反应则生成 0.2mol H2
(4)将此 18.0g A 在足量纯 O2 中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重 10.8g 和 26.4g.
根据以上实验,可以得出的结论:
(1)A 的相对分子质量为:90
(2)A 中含有C种氢原子. 本题涂卡30
A.2 B.3 C.4 D.5
(3)A 的分子式为:C3H6O3
(4)B是A的同分异构体,与A含有相同的官能团,B在一定条件下可以反应生成八元环,试写出该反应的方程式
 .
.
分析 (1)相同条件下,气体的相对分子质量之比等于密度之比;
(2)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子;
(3)浓硫酸吸收水,碱石灰可以吸收二氧化碳,根据元素守恒来确定有机物的分子式;
(4)峰面积之比等于氢原子的数目之比,结合以上分析确定A的结构简式,并得B的结构式,并书写方程式.
解答 解:(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,
故答案为:90;
(2)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,故选C,
故答案为:C;
(3)18.0gA的物质的量=$\frac{18.0g}{90g/mol}$=0.2mol,浓硫酸增重10.8g,则生成水的质量是10.8g,生成n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,所含有n(H)是1.2mol,碱石灰增重26.4g,生成m(CO2)是26.4g,n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,所以n(C)是0.6mol,则n(A):n(C):n(H)=0.2mol:0.6mol:1.2mol=1:3:6,则有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,
故答案为:C3H6O3;
(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以A的结构简式为: ,B是A的同分异构体,与A含有相同的官能团,故B的结构简式为
,B是A的同分异构体,与A含有相同的官能团,故B的结构简式为 ,B在一定条件下可以反应生成八元环,故方程式为
,B在一定条件下可以反应生成八元环,故方程式为 ,
,
故答案为: .
.
点评 本题是一道关于有机物的结构和性质知识的综合推断题,考查学生对知识的整合能力,难度中等,注意A和钠反应时,不仅羟基和钠反应,羧基也和钠反应,为易错点.

| A. | 甲烷和氯气反应属于取代反应 | |
| B. | 乙烯和溴水反应属于取代反应 | |
| C. | 乙醇和酸性高锰酸钾溶液反应属于氧化反应 | |
| D. | 苯燃烧属于氧化反应 |
| A. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | B. | 价电子数:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 第一电离能:Na<Mg<Al |
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol?L-1的氨水中滴加0.1 mol?L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol?L-1 | |
| C. | 将c mol?L-1的醋酸溶液与0.02 mol?L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{{2×1{0^{-9}}}}{c-0.02}$ | |
| D. | 将0.2 mol•L-1盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序: c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
| A. | XeF2 | B. | H2O | C. | CCl4 | D. | PCl5 |
| A. | 用湿润的pH试纸测稀盐酸的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液 | |
| C. | 用托盘天平称取5.85 gNaCl晶钵 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
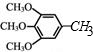 )是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下:
)是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下: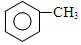 $\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$
$\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$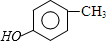 $→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$
$→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$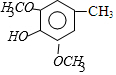 $\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
$\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$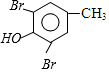 ,C的结构简式为
,C的结构简式为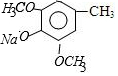 .
.