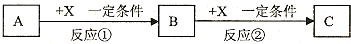
题目内容
18.A、B、C、D、E、F分别是KCl、Mg(NO3)2、Ba(OH)2、AgNO3、Na2CO3、(NH4)2SO4六种溶液的一种,将它们两混合后,现象如下表.表中用“↑”代表产生气体,用“↓”代表产生沉淀,用“-”代表无现象.| A | B | C | D | E | F | |
| A | ↑↓ | - | - | ↓ | - | |
| B | ↑↓ | ↓ | - | ↓ | ↓ | |
| C | - | ↓ | - | - | ↓ | |
| D | - | - | - | ↓ | - | |
| E | ↓ | ↓ | - | ↓ | ↓ | |
| F | - | ↓ | ↓ | - | ↓ |
(1)这六种溶液分别是EAgNO3 FNa2CO3
(2)试写出A与B反应的离子方程式:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3↑+2H2O.
分析 KCl、Mg(NO3)2、Ba(OH)2、AgNO3、Na2CO3、(NH4)2SO4六种溶液中,A与B反应生成沉淀和气体,A只与N、E反应生成沉淀,可知A、B为Ba(OH)2、(NH4)2SO4中的一种,(NH4)2SO4与Ba(OH)2、AgNO3反应生成沉淀,可知A为Ba(OH)2,B为(NH4)2SO4,E与B、D、F均生成沉淀,可知E为AgNO3,F与B、C、E生成沉淀,F为Na2CO3,以此来解答.
解答 解:KCl、Mg(NO3)2、Ba(OH)2、AgNO3、Na2CO3、(NH4)2SO4六种溶液中,A与B反应生成沉淀和气体,A只与N、E反应生成沉淀,可知A、B为Ba(OH)2、(NH4)2SO4中的一种,(NH4)2SO4与Ba(OH)2、AgNO3反应生成沉淀,可知A为Ba(OH)2,B为(NH4)2SO4,E与B、D、F均生成沉淀,可知E为AgNO3,F与B、C、E生成沉淀,F为Na2CO3,D只与E反应生成沉淀,D为KCl,则C为Mg(NO3)2,
(1)由上述分析可知,E为AgNO3,F为Na2CO3,故答案为:AgNO3;Na2CO3;
(2)A与B反应的离子方程式为Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3↑+2H2O,故答案为:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3↑+2H2O.
点评 本题考查无机物的推断,为高频考点,把握物质之间的反应及现象推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
8.物质结构理论推出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键.金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强,由此判断下列说法错误的是( )
| A. | 钠的硬度大于铝 | B. | 镁的熔沸点高于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔沸点高于钾 |
9.下列化合物不能由单质之间直接化合得到的是( )
| A. | NO2 | B. | FeS | C. | SO2 | D. | FeCl3 |
10.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑十H2O | |
| C. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
7.下列有关化学用语表达不正确的是( )
| A. | 二氧化碳的结构式:O=C=O | B. | 氯离子的结构示意图: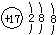 | ||
| C. | 钙离子的电子式:Ca2+ | D. | 溴化氢分子的电子式: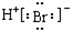 |
8.下列说法正确的是( )
| A. | 标准状况下,1mol H2O的体积为22.4L | |
| B. | 1mol•L-1的氯化钠溶液是指此溶液中含有1mol NaCl | |
| C. | 从1L 1mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol•L-1 | |
| D. | 以g•mol-1为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等 |