题目内容
下列叙述正确的是( )
| A、在氧化还原反应中,非金属单质一定是氧化剂 |
| B、置换反应一定是氧化还原反应 |
| C、阳离子只能得到电子,阴离子只能失去电子 |
| D、金属阳离子被还原一定得到金属单质 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.S、P、C等可被氧化;
B.置换反应有单质参加,元素化合价发生变化;
C.Fe2+可失去电子,ClO-可得到电子;
D.Fe3+被还原可得到Fe2+.
B.置换反应有单质参加,元素化合价发生变化;
C.Fe2+可失去电子,ClO-可得到电子;
D.Fe3+被还原可得到Fe2+.
解答:
解:A.氧化还原反应中非金属不一定是氧化剂,如S、P、C等可被氧化,故A错误;
B.置换反应有单质参加,元素化合价发生变化,一定属于氧化还原反应,故B正确;
C.Fe2+可失去电子,ClO-可得到电子,故C错误;
D.Fe3+被还原可得到Fe2+,被还原不一定得到单质,故D错误.
故选B.
B.置换反应有单质参加,元素化合价发生变化,一定属于氧化还原反应,故B正确;
C.Fe2+可失去电子,ClO-可得到电子,故C错误;
D.Fe3+被还原可得到Fe2+,被还原不一定得到单质,故D错误.
故选B.
点评:本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,答题时注意能举出实例,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列说法正确的是( )
| A、将蔗糖溶于水不能导电且其熔融状态也不能导电,故蔗糖不是电解质 |
| B、CO2溶于水得到的溶液能导电,所以CO2是电解质 |
| C、金属能导电,所以金属是电解质 |
| D、固态的NaCl不导电,所以 NaCl不是电解质 |
将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为4:1,则原混合物中氧化铁与铁的物质的量之比为( )
| A、1:1 | B、2:5 |
| C、1:2 | D、3:1 |
下列反应中,必须加入氧化剂才能进行的是( )
| A、Cl2→ClO- |
| B、Zn→Zn2+ |
| C、Na2O2→O2 |
| D、CuO→CuCl2 |
工业上常利用反应3Cl2+8NH3═N2+6NH4Cl检查氯气管道是否漏气.下列说法错误的是( )
| A、该反应属于氧化还原反应 |
| B、反应中NH3表现强氧化性 |
| C、生成28gN2有6mol电子转移 |
| D、反应后Cl2被还原 |
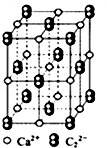 CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A、6.4克CaC2晶体中含阴离子0.2 mol |
| B、该晶体中的阴离子与N2是互为等电子体 |
| C、1个Ca2+周围距离最近且等距离的C22-数目为6 |
| D、与每个Ca2+距离相等且最近的Ca2+共有12个 |
下列反应的离子方程式中,书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、金属钾投入到硫酸铜溶液中:2K+Cu2+=2K++Cu |
| D、铜跟稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数是最外层的2倍,元素的化合价关系如下表,则下列判断正确的是( )
| X | Y | Z | R | |
| 主要化合物 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A、非金属性:Z<R<Y |
| B、T与R可以形成化合物TR2 |
| C、X与R的单质均能使品红溶液褪色 |
| D、T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应 |