题目内容
将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为4:1,则原混合物中氧化铁与铁的物质的量之比为( )
| A、1:1 | B、2:5 |
| C、1:2 | D、3:1 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:含有氧化铁的铁丝投入足量的稀硫酸中,经分析,溶液中无Fe3+,发生反应:Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe=3FeSO4,设原混合物中含有xmolFe,ymolFe2O3,根据反应的方程式计算.
解答:
解:设原混合物中含有xmolFe,ymolFe2O3,则:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
ymol ymol
Fe2(SO4)3+Fe=3FeSO4
ymol ymol 3ymol
Fe+H2SO4=FeSO4+H2↑
(x-y)mol (x-y)mol (x-y)mol
则:[3ymol+(x-y)mol]:(x-y)mol=4:1,
整理得y:x=1:2,
故选C.
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
ymol ymol
Fe2(SO4)3+Fe=3FeSO4
ymol ymol 3ymol
Fe+H2SO4=FeSO4+H2↑
(x-y)mol (x-y)mol (x-y)mol
则:[3ymol+(x-y)mol]:(x-y)mol=4:1,
整理得y:x=1:2,
故选C.
点评:本题考查Fe元素单质化合物性质、化学方程式的有关计算等,为高频考点,侧重于学生的分析能力和计算能力的考查,注意对方程式的运用,难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | CO2 | Ca(OH)2 | Na2CO3 |
| A、A | B、B | C、C | D、D |
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A、K+、OH-、CO32- |
| B、Cu2+、H+、Cl- |
| C、K+、H+、Cl- |
| D、CO32-、OH-、Cl- |
常温时,下列溶液中各粒子物质的量浓度关系正确的是( )
| A、0.1 mol?L-1,pH=4 的 NaHB 溶液中:c(HB-)>c(H2B)>c(B2-) |
| B、10 mL 0.5 mol?L-1 CH3COONa 溶液与 6 mL 1 mol?L-1盐酸混合后的溶液中:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、c(NH4+) 相等的 (NH4)2SO4溶液、(NH4)2CO3溶液和 NH4NO3溶液中:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4NO3) |
| D、NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
下列变化中,属于被氧化的是( )
| A、CaO→Ca(OH)2 |
| B、Cu2+→Cu |
| C、Fe2+→Fe3+ |
| D、CO2→CO |
下列物质的俗名与其化学式不相对应的是( )
| A、小苏打一Na2CO3?10H2O |
| B、生石灰-CaO |
| C、石英-SiO2 |
| D、烧碱一NaOH |
下列叙述正确的是( )
| A、在氧化还原反应中,非金属单质一定是氧化剂 |
| B、置换反应一定是氧化还原反应 |
| C、阳离子只能得到电子,阴离子只能失去电子 |
| D、金属阳离子被还原一定得到金属单质 |
关于周期表的知识,下列说法正确的是( )
| A、周期表共有七个主族,七个副族,一个零族,一个第八族,所以共有16个纵列 |
| B、元素周期表中,元素种类最多的周期是第四周期 |
| C、第七周期叫做不完全周期 |
| D、碱金属元素就是ⅠA元素 |
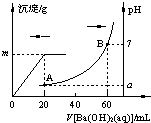 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |