题目内容
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标况下,2.24LHF中所含电子数为0.1NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
分析 A、标况下,HF为液态;
B、求出乙醛的物质的量,然后根据1mol乙醛中含6molσ键来分析;
C、Fe完全转变为Fe3O4后,铁元素的价态变为+$\frac{8}{3}$价;
D、过氧化钠由2个钠离子和1个过氧根构成.
解答 解:A、标况下,HF为液态,不能根据气体摩尔体积来计算,故A错误;
B、4.4g乙醛的物质的量为0.1mol,而1mol乙醛中含6molσ键,故0.1mol乙醛中含0.6molσ键即0.6NA个,故B错误;
C、Fe完全转变为Fe3O4后,铁元素的价态变为+$\frac{8}{3}$价,故3mol铁失去8mol电子即8NA个,故C正确;
D、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3mol离子即3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.五种短周期元素X、Y、Z、W、M,X的质子总数与电子层数相同,Y、Z、W、M在周期表中的位置如图所示,其中W的单质是一种重要的半导体材料.下列说法不正确的是( )
| Y | Z | M |
| W |
| A. | 原子半径大小关系为:W>Y>Z>M>X | |
| B. | 最高价氧化物对应的水化物酸性:W<Y<Z | |
| C. | 分子式为X5YZM2的化合物中含有离子键和共价键 | |
| D. | 元素Y、W的单质一定属于同种类型的晶体 |
8.如图是立方烷的球棍模型,下列有关说法不正确的是( )


| A. | 其一氯代物有二种 | |
| B. | 其二氯代物有三种同分异构体 | |
| C. | 它是一种烃分子 | |
| D. | 它与苯乙烯(CH5-CH═CH2)互为同分异构体 |
5.下列有关油脂的叙述错误的是( )
| A. | 油脂属于酯类 | B. | 植物油能使溴水褪色 | ||
| C. | 油脂能溶解维生素A | D. | 油脂的水解反应称皂化反应 |
12.下列有关离子(或物质)的检验及结论正确的是( )
| A. | 向黄色溶液中加入淀粉,溶液变蓝色,则溶液中含有I2 | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42- | |
| C. | 向无色溶液中加入稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,则溶液中含有NH4+ | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有Na+不含K+ |
2.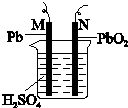 已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
 已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )| A. | 充电时,阳极的电极反应式为:PbSO4+2e-═Pb+SO42- | |
| B. | 充电时,若N连接电源正极,则该极生成PbO2 | |
| C. | 放电时,c(H2SO4)不变,两极的质量增加 | |
| D. | 放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-═PbSO4+2H2O |
9.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
| A. | 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 | |
| B. | 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 | |
| C. | 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) | |
| D. | 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol•L-1 |
6.下列说法中正确的是( )
| A. | 在任何状况下,1 mol CO2和1 mol H2O所含的分子数和原子数都相等 | |
| B. | 只有在标准状况下,1 mol气体所占的体积才是22.4 L | |
| C. | 某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4 L | |
| D. | 22.4 L CO所含的分子数为6.02×1023个 |
7.下列各方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | HS-+H2O?S2-+H3O+ | ||
| C. | HCO3-+OH-?CO32-+H2O | D. | CO32-+H2O?HCO3-+OH- |