题目内容
 为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:
为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:步骤I:称取样品1.000g;
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀;
步骤Ⅲ:用0.1000mol/L盐酸标准溶液滴定步骤Ⅱ配制的溶液;
步骤IV:根据实验数据,计算混合物样品中NaOH的质量分数.
(1)步骤II要用到的玻璃仪器有:250mL容量瓶,烧杯、玻璃棒和
(2)步骤III的实验操作如下:
A.用碱式滴定管移取待测液于锥形瓶中,滴加2-3滴酚酞指示剂.
B.洗涤并润洗滴定管.
C.将盐酸标准溶液注入酸式滴定管,调节液面至“0”或“0”以下并使尖嘴部分无气泡,读取液面刻度.
D.检查滴定管是否漏水.
E.重复滴定操作三次.
F.在锥形瓶下垫一张白纸,用盐酸标准溶液至终点,读取液面刻度.
根据上述操作,完成下列填空:
①上述实验操作的正确顺序是
②F步操作中判断滴定终点的依据是
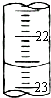
③如图是某次滴定时的滴定管中的液面,其读数为
④下列操作会导致测定的NaOH的质量分数偏高的是
A.锥形瓶用蒸馏水洗涤后,未干燥.
B.酸式滴定管用蒸馏水洗涤后未润洗,直接加入盐酸标准溶液进行滴定.
C.酸式滴定管在滴定前尖嘴处有气泡,滴定终了无气泡.
D.滴定前平视,滴定终了俯视
(3)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.00 | 21.01 |
| 2 | 25.00 | 2.00 | 24.00 |
| 3 | 25.00 | 0.20 | 20.19 |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:(1)配制一定物质的量浓度的溶液所需玻璃仪器除容量瓶外还有:烧杯、玻璃棒、胶头滴管;
(2)①中和滴定的步骤有:检查滴定管、洗涤滴定管、装液、读数、取待测液、滴定、读数、用剩药品处理、洗涤;
②用盐酸滴定氢氧化钠溶液时的滴定终点时,溶液颜色变化且不再恢复;
③注意滴定管精确到0.01mL;
④据c(NaOH)=
,看分子上的V(HCl)和分母上的V(NaOH)的误差分析;
(3)分析上述数据,滴定2误差较大,舍去,取滴定1和滴定3的平均值计算即可.
(2)①中和滴定的步骤有:检查滴定管、洗涤滴定管、装液、读数、取待测液、滴定、读数、用剩药品处理、洗涤;
②用盐酸滴定氢氧化钠溶液时的滴定终点时,溶液颜色变化且不再恢复;
③注意滴定管精确到0.01mL;
④据c(NaOH)=
| c(HCl)?V(HCl) |
| V(NaOH) |
(3)分析上述数据,滴定2误差较大,舍去,取滴定1和滴定3的平均值计算即可.
解答:
解:(1)配制一定物质的量浓度的溶液所需玻璃仪器除容量瓶外还有:烧杯、玻璃棒、胶头滴管,故答案为:胶头滴管;
(2)①中和滴定的步骤有:检查滴定管、洗涤滴定管、装液、读数、取待测液、滴定、读数、用剩药品处理、洗涤,所以上述实验操作的正确顺序为:D-B-C-A-F-E,故答案为:D-B-C-A-F-E;
②酸滴定碱用无色的酚酞作指示剂,当滴加最后一滴时,锥形瓶中溶液由红色突变为无色,且半分钟内不恢复,说明达到滴定终点,故答案为:当滴加最后一滴时,锥形瓶中溶液由红色突变为无色,且半分钟内不恢复;
③注意滴定管精确到0.01mL,上图读数为:22.60mL,故答案为:22.60;
④c(NaOH)=
,
A、锥形瓶内有水与否对滴定结果无影响,故A错误;
B、酸式滴定管润洗,导致分子上V(HCl)增大,c(NaOH)增大,故B正确;
C、酸式滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,导致分子上V(HCl)增大,c(NaOH)增大,故C正确;
D、滴定前平视,滴定终了俯视,导致分子上V(HCl)减小,c(NaOH)减小,故D错误;
故选BC;
(3)分析上述数据,滴定2误差较大舍去,取滴定1和滴定3的平均值计算,所需盐酸体积为:
=20mL,
1.00gNaOH配制的250mL溶液中的25mL中和盐酸的物质的量为:0.02L×0.1000mol/L=0.002mol,25mLNaOH溶液中含有m(NaOH)=0.002mol×40g/mol=0.08g,则250mL溶液中含有NaOH的质量为0.8g,
×100%=80.00%,故答案为:80.00%.
(2)①中和滴定的步骤有:检查滴定管、洗涤滴定管、装液、读数、取待测液、滴定、读数、用剩药品处理、洗涤,所以上述实验操作的正确顺序为:D-B-C-A-F-E,故答案为:D-B-C-A-F-E;
②酸滴定碱用无色的酚酞作指示剂,当滴加最后一滴时,锥形瓶中溶液由红色突变为无色,且半分钟内不恢复,说明达到滴定终点,故答案为:当滴加最后一滴时,锥形瓶中溶液由红色突变为无色,且半分钟内不恢复;
③注意滴定管精确到0.01mL,上图读数为:22.60mL,故答案为:22.60;
④c(NaOH)=
| c(HCl)?V(HCl) |
| V(NaOH) |
A、锥形瓶内有水与否对滴定结果无影响,故A错误;
B、酸式滴定管润洗,导致分子上V(HCl)增大,c(NaOH)增大,故B正确;
C、酸式滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,导致分子上V(HCl)增大,c(NaOH)增大,故C正确;
D、滴定前平视,滴定终了俯视,导致分子上V(HCl)减小,c(NaOH)减小,故D错误;
故选BC;
(3)分析上述数据,滴定2误差较大舍去,取滴定1和滴定3的平均值计算,所需盐酸体积为:
| (21.01-1.00)+(20.19-0.20) |
| 2 |
1.00gNaOH配制的250mL溶液中的25mL中和盐酸的物质的量为:0.02L×0.1000mol/L=0.002mol,25mLNaOH溶液中含有m(NaOH)=0.002mol×40g/mol=0.08g,则250mL溶液中含有NaOH的质量为0.8g,
| 0.8g |
| 1.000g |
点评:本题考查了配制一定物质的量浓度的溶液和酸碱滴定的实验过程以及误差分析,题目难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列有关化学用语的表示,正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、醛基的结构简式:-COH |
C、丙烷分子的比例模型为: |
D、甲烷的电子式: |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- |
| B、常温下,c(H+)/c(OH-)=1010的溶液中:Na+、NH4+、ClO-、I- |
| C、0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- |
| D、水电离出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- |
下列能达到实验目的是( )


| A、①吸收氨气制氨水 |
| B、②制取少量蒸馏水 |
| C、③向容量瓶中转移溶液 |
| D、④除去CO中的杂质气体CO2 |
 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.